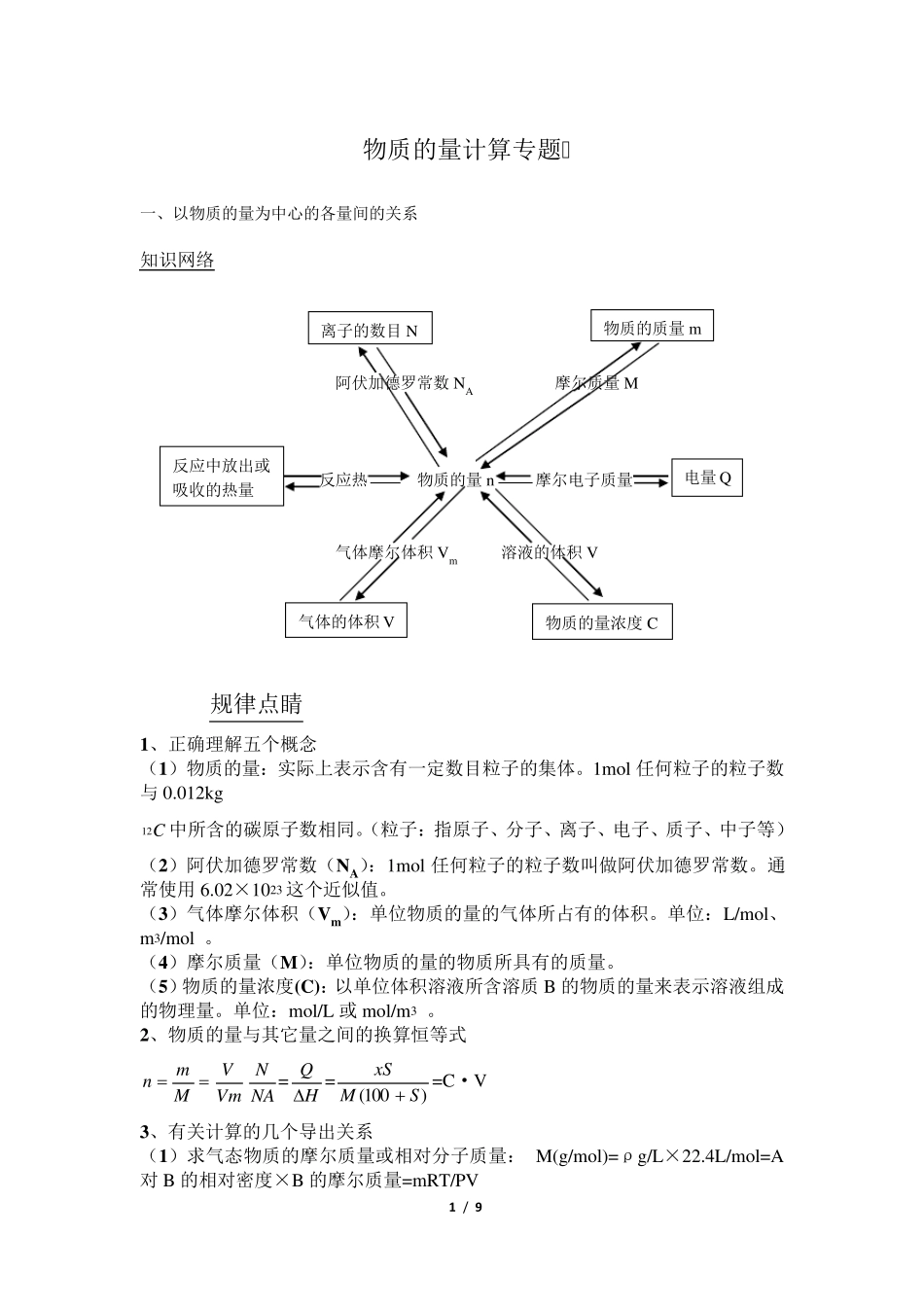
1 / 9 物质的量计算专题 一、以物质的量为中心的各量间的关系 知识网络 阿伏加德罗常数NA 摩尔质量M 反应热 物质的量n 摩尔电子质量 气体摩尔体积Vm 溶液的体积V 规律点睛 1、正确理解五个概念 (1)物质的量:实际上表示含有一定数目粒子的集体。1mol 任何粒子的粒子数与0.012kg C12中所含的碳原子数相同。(粒子:指原子、分子、离子、电子、质子、中子等) (2)阿伏加德罗常数(NA):1mol 任何粒子的粒子数叫做阿伏加德罗常数。通常使用6.02×1023 这个近似值。 (3)气体摩尔体积(Vm):单位物质的量的气体所占有的体积。单位:L/mol、m3/mol 。 (4)摩尔质量(M):单位物质的量的物质所具有的质量。 (5)物质的量浓度(C):以单位体积溶液所含溶质B 的物质的量来表示溶液组成的物理量。单位:mol/L 或mol/m3 。 2、物质的量与其它量之间的换算恒等式 MmnVmVNAN =HQ=)100(SMxS=C·V 3、有关计算的几个导出关系 (1)求气态物质的摩尔质量或相对分子质量: M(g/mol)=ρg/L×22.4L/mol=A对 B 的相对密度×B 的摩尔质量=mRT/PV 离子的数目N 物质的质量m 反应中放出或 吸收的热量 电量Q 气体的体积V 物质的量浓度C 2 / 9 (2)比较气体分子数目的多少:关键是比较气体的物质的量的大小。即:n1:n2=N1:N2 (3)比较气体在相同条件下体积的大小:关键是比较气体的物质的量的大小。即: n1:n2=V1:V2 (4)关于物质的量浓度的计算 ① C(B)=VLnmolLmolMgmLdgmL1//1000 ② C(浓溶液)·V(浓溶液)=C(稀溶液)·V(稀溶液) 二、阿伏加德罗定律的应用 知识网络 概念:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。 同温、同压:n1:n2=V1:V2=N1:N2 阿伏加德定律 推论 同温、同压、同质量:V1:V2=M1:M2 同温、同压:ρ1:ρ2=M1:M2 同温、同体积:n1:n2=p1:p2 规律点睛 1、气体的密度和相对密度 标准状况下,气体的密度ρ(g/L)=M(g/mol)/22.4 (L/mol) D(相对密度)=ρ1/ρ2=M1/M2 2、求相对分子质量M (或平均相对分子质量M )的几种方法 (1) M=22.4ρ (2) M =baBbMAaM)()(【a、b 为物质的量M(A)、M(B)为摩尔质量】 (3) M =M(A)·m%+M(B)·n%【m%、n%为 A、B 的体积分数】 3、确定气体分子组成 若 2 体积气体Ax于1 体积气体By恰好完全反应生成 A2B,由阿伏加德罗定律可知:气体的分子数之比等于体积比,即 Ax:By:A2B=2...