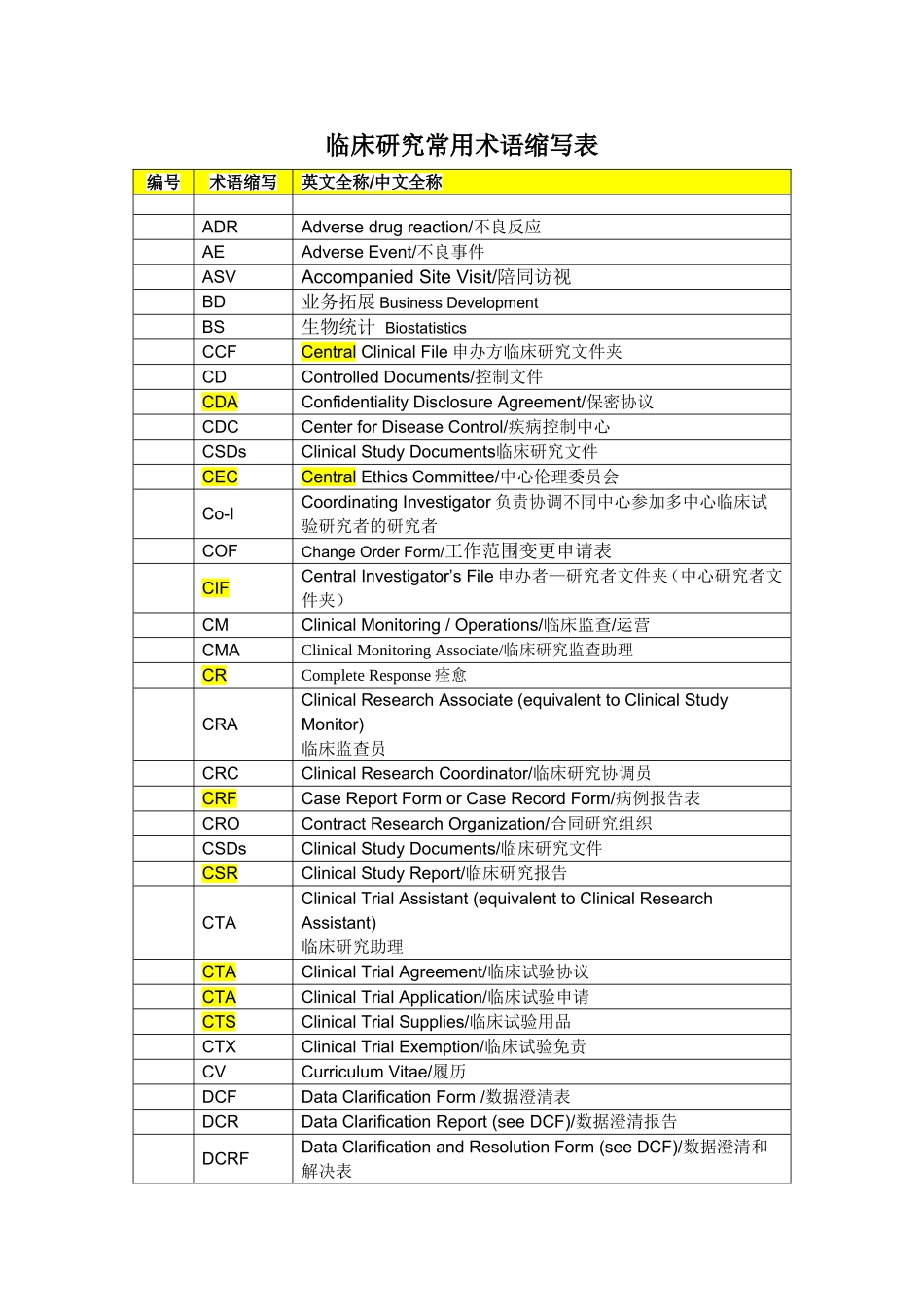
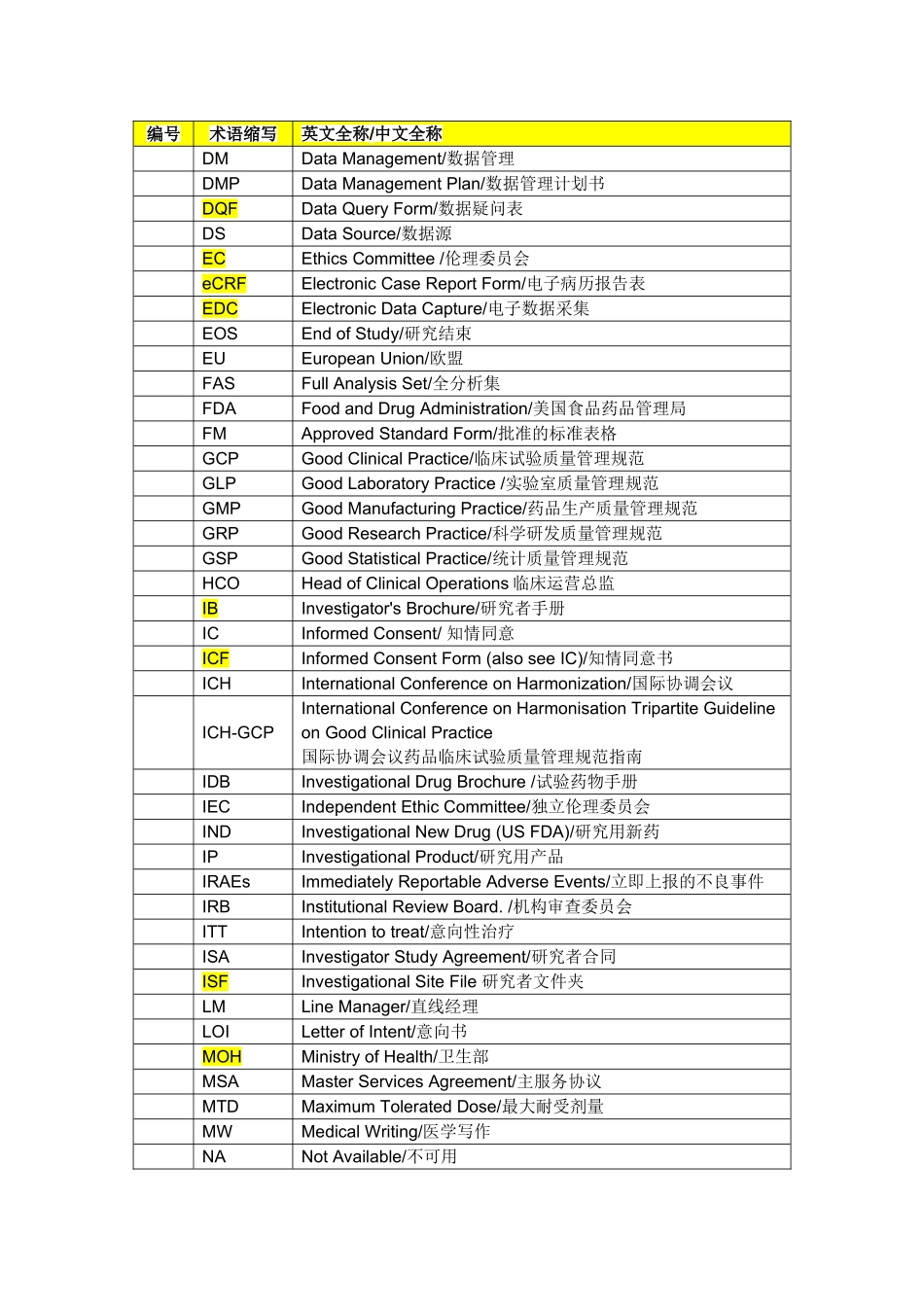
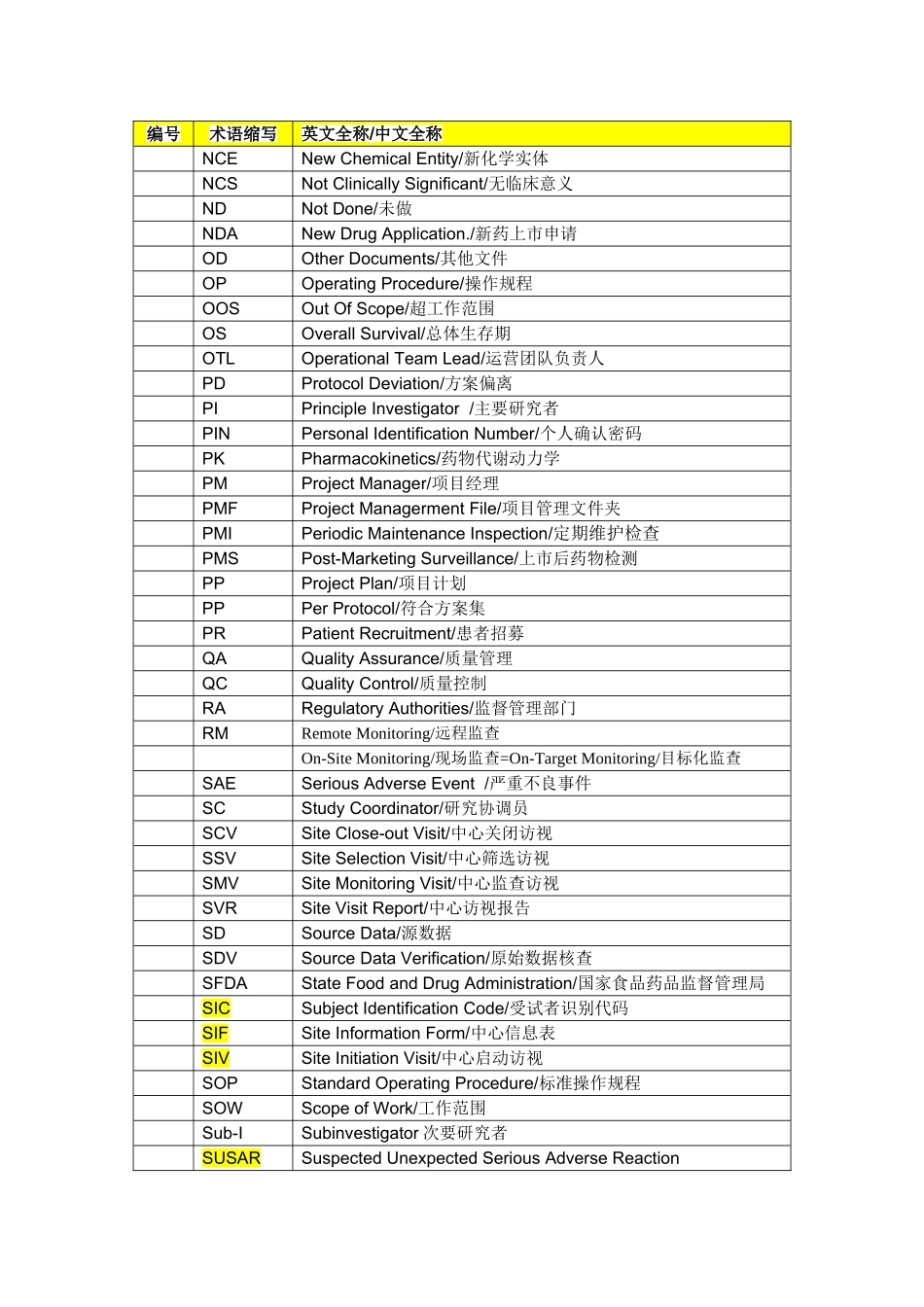
临床研究常用术语缩写表编号术语缩写英文全称/中文全称ADRAdversedrugreaction/不良反应AEAdverseEvent/不良事件ASVAccompaniedSiteVisit/陪同访视BD业务拓展BusinessDevelopmentBS生物统计BiostatisticsCCFCentralClinicalFile申办方临床研究文件夹CDControlledDocuments/控制文件CDAConfidentialityDisclosureAgreement/保密协议CDCCenterforDiseaseControl/疾病控制中心CSDsClinicalStudyDocuments临床研究文件CECCentralEthicsCommittee/中心伦理委员会Co-ICoordinatingInvestigator负责协调不同中心参加多中心临床试验研究者的研究者COFChangeOrderForm/工作范围变更申请表CIFCentralInvestigator’sFile申办者—研究者文件夹(中心研究者文件夹)CMClinicalMonitoring/Operations/临床监查/运营CMAClinicalMonitoringAssociate/临床研究监查助理CRCompleteResponse痊愈CRAClinicalResearchAssociate(equivalenttoClinicalStudyMonitor)临床监查员CRCClinicalResearchCoordinator/临床研究协调员CRFCaseReportFormorCaseRecordForm/病例报告表CROContractResearchOrganization/合同研究组织CSDsClinicalStudyDocuments/临床研究文件CSRClinicalStudyReport/临床研究报告CTAClinicalTrialAssistant(equivalenttoClinicalResearchAssistant)临床研究助理CTAClinicalTrialAgreement/临床试验协议CTAClinicalTrialApplication/临床试验申请CTSClinicalTrialSupplies/临床试验用品CTXClinicalTrialExemption/临床试验免责CVCurriculumVitae/履历DCFDataClarificationForm/数据澄清表DCRDataClarificationReport(seeDCF)/数据澄清报告DCRFDataClarificationandResolutionForm(seeDCF)/数据澄清和解决表编号术语缩写英文全称/中文全称DMDataManagement/数据管理DMPDataManagementPlan/数据管理计划书DQFDataQueryForm/数据疑问表DSDataSource/数据源ECEthicsCommittee/伦理委员会eCRFElectronicCaseReportForm/电子病历报告表EDCElectronicDataCapture/电子数据采集EOSEndofStudy/研究结束EUEuropeanUnion/欧盟FASFullAnalysisSet/全分析集FDAFoodandDrugAdministration/美国食品药品管理局FMApprovedStandardForm/批准的标准表格GCPGoodClinicalPractice/临床试验质量管理规范GLPGoodLaboratoryPractice/实验室质量管理规范GMPGoodManufacturingPractice/药品生产质量管理规范GRPGoodResearchPractice/科学研发质量管理规范GSPGoodStatisticalPractice/统计质量管理规范HCOHeadofClinicalOperations临床运营总监IBInvestigator'sBrochure/研究者手册ICInformedConsent/知情同意ICFInformedConsentForm(alsoseeIC)/知情同意书ICHInternationalConferenceonHarmonization/国际协调会议ICH-GCPInternationalConferenceonHarmonisationTripartiteGuidelineonGoodClinicalPractice国际协调会议药品临床试验质量管理规范指南IDBInvestigationalDrugBrochure/试验药物手册IECIndependentEthicCommittee/独立伦理委员会INDInvestigationalNewDrug(USFDA)/研究用新药IPInvestigationalProduct/研究用产品IRAEsImmediatelyReportableAdverseEvents/立即上报的不良事件IRBInstitutionalReviewBoard./机构审查委员会ITTIntentiontotreat/意向性治疗ISAInvestigatorStudyAgreement/研究者合同ISFInvestigationalSiteFile研究者文件夹LMLineManager/直线经理LOILetterofIntent/意向书MOHMinistryofHealth/卫生部MSAMasterServicesAgreement/主服务协议MTDMaximumToleratedDose/最大耐受剂量MWMedicalWriting/医学写作NANotAvailable/不可用编号术语缩写英文全称/中文全称NCENewChemicalEntity/新化学实体NCSNotClinicallySignificant/无临床意义NDNotDone/未做NDANewDrugApplication./新药上市申请ODOtherDocuments/其他文件OPOperatingProcedure/操作规程OOSOutOfScope/超工作范围OSOverallSurvival/总体生存期OTLOperationalTeamLead/运营团队负责人PDProtocolDeviation/方案偏离PIPrincipleInvestigator/主要研究者PINPersonalIdentificationNumber/个人确认密码PKPharmacokinetics/药物代谢动...