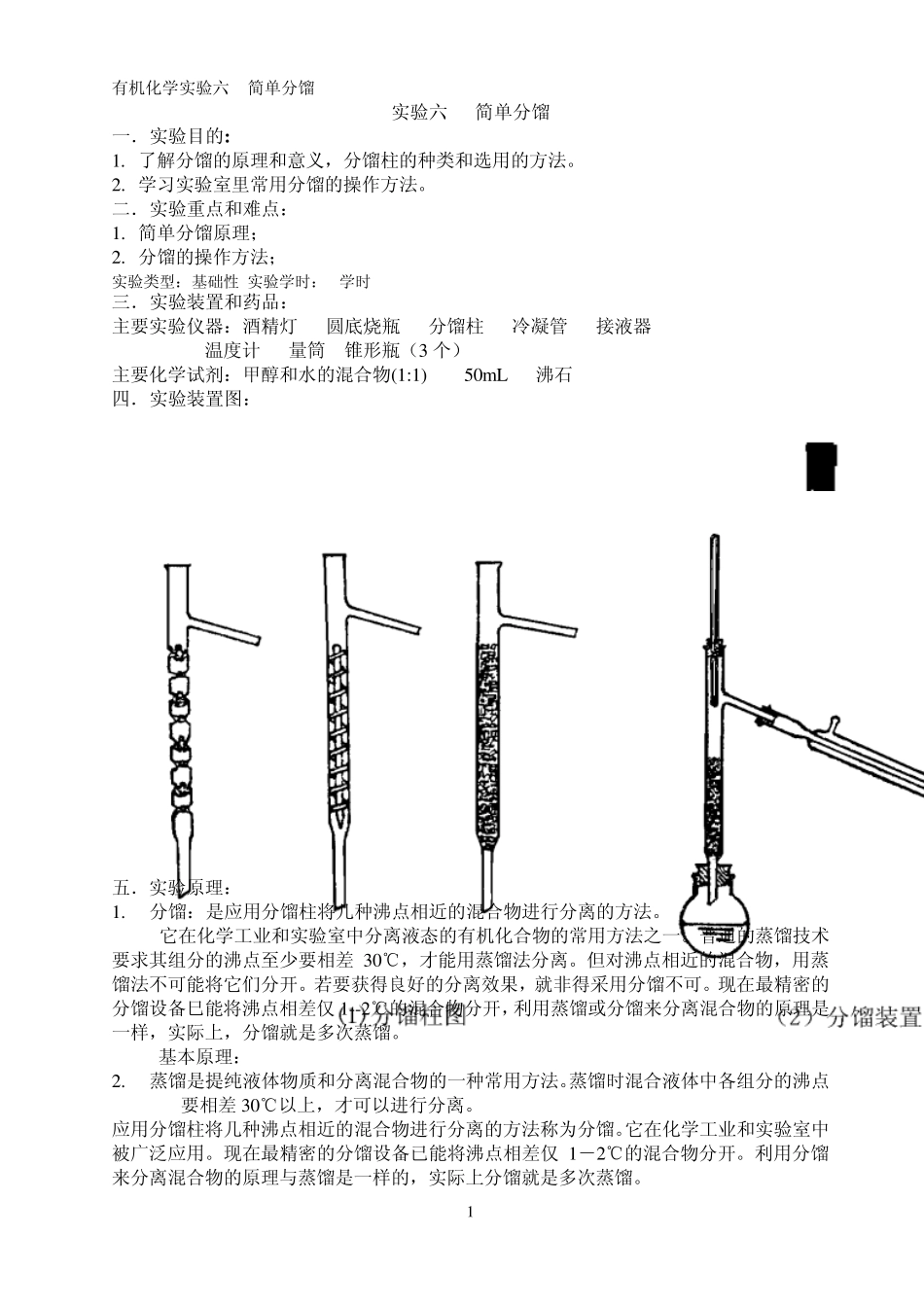
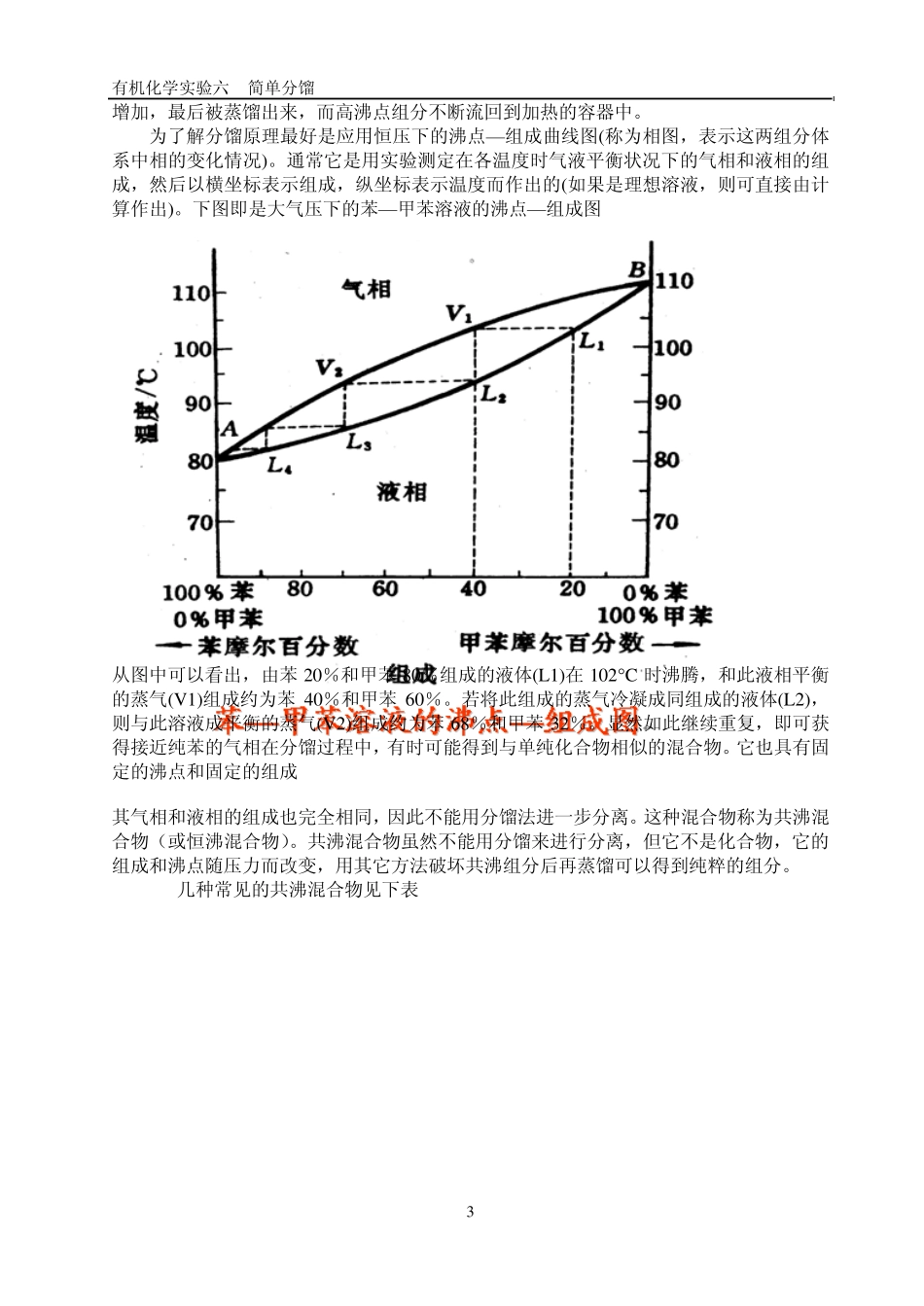
有机化学实验六 简单分馏 1 实验六 简单分馏 一. 实验目的: 1. 了解分馏的原理和意义,分馏柱的种类和选用的方法。 2. 学习实验室里常用分馏的操作方法。 二. 实验重点和难点: 1. 简单分馏原理; 2. 分馏的操作方法; 实验类型:基础性 实验学时:4学时 三. 实验装置和药品: 主要实验仪器:酒精灯 圆底烧瓶 分馏柱 冷凝管 接液器 温度计 量筒 锥形瓶(3 个) 主要化学试剂:甲醇和水的混合物(1:1) 50m L 沸石 四. 实验装置图: 五.实验原理: 1. 分馏:是应用分馏柱将几种沸点相近的混合物进行分离的方法。 它在化学工业和实验室中分离液态的有机化合物的常用方法之一。普通的蒸馏技术要求其组分的沸点至少要相差30℃,才能用蒸馏法分离。但对沸点相近的混合物,用蒸馏法不可能将它们分开。若要获得良好的分离效果,就非得采用分馏不可。现在最精密的分馏设备巳能将沸点相差仅 1--2℃的混合物分开,利用蒸馏或分馏来分离混合物的原理是一样,实际上,分馏就是多次蒸馏。 基本原理: 2. 蒸馏是提纯液体物质和分离混合物的一种常用方法。蒸馏时混合液体中各组分的沸点要相差30℃以上,才可以进行分离。 应用分馏柱将几种沸点相近的混合物进行分离的方法称为分馏。它在化学工业和实验室中被广泛应用。现在最精密的分馏设备已能将沸点相差仅 1-2℃的混合物分开。利用分馏来分离混合物的原理与蒸馏是一样的,实际上分馏就是多次蒸馏。 有机化学实验六 简单分馏 2 将几种具有不同沸点而又可以完全互溶的液体混合物加热,当其总蒸气压等于外界压力时,就开始沸腾气化,蒸气中易挥发液体的成分较在原混合液中为多。为了简化,我们仅讨沦混合物是二组分理想溶液的情况,所谓理想溶液即是指在这种溶液中,相同分子间的相互作用与不同分子间的相互作用是一样的。也就是各组分在混合时无热效应产生,体积没有改变。只有理想溶液才遵守拉乌尔定律。 拉乌尔定律 溶液中每一组分的蒸气压等于此纯物质的蒸气压和它在溶液中的摩尔分数的乘积。亦即: PA、PB 分别为溶液中A 和B 组分的分压。 、 分别为纯A 和纯B 的蒸气压,X A 和X B 别为A 和B 在溶液中的摩尔分数。 溶液的总蒸气压: P =PA +PB 道尔顿分压定律 根据道尔顿分压定律,气相中每一组分的蒸气压和它的摩尔分数成正比。因此在气相中各组分蒸气的成分为: 在将此蒸气冷凝得到的液体中,B 的组分比在原来的液体中多(这...