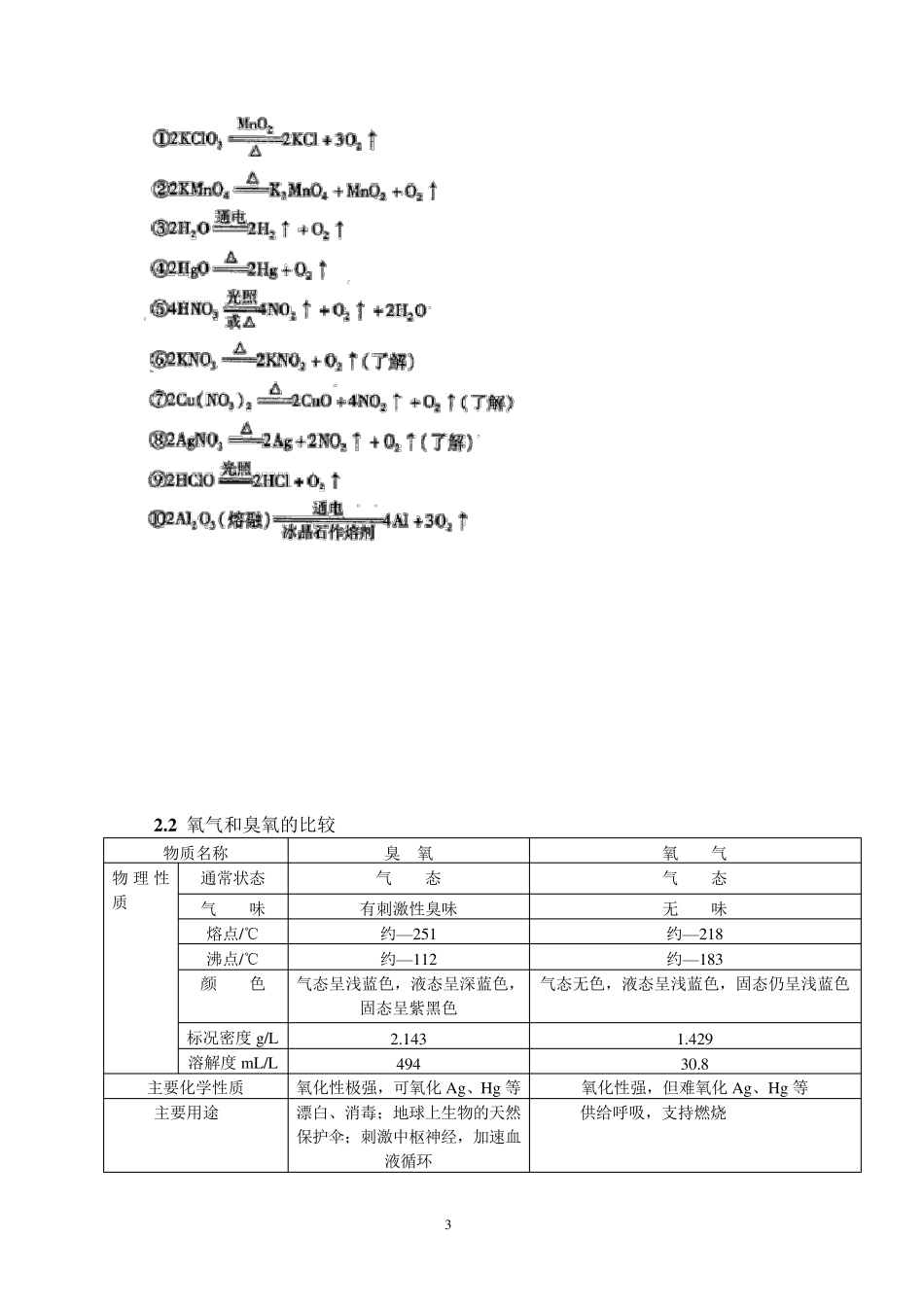
1 2H2O2===2H2O+O2 ↑ MnO2 氧族元素 1 .复习重点 1.氧族元素的物理性质和化学性质的递变规律; 2.硫单质、臭氧、过氧化氢、硫化氢的物理性质与化学性质; 3.重点是硫的化学性质及氧族元素性质递变规律。 2 .难点聚焦 (一)、氧族元素的原子结构及性质的递变规律 元素 氧(O) 硫(S) 硒(Se) 碲(Te) 核电荷数 8 16 34 52 最外层电子数 6 6 6 6 电子层数 2 3 4 5 化合价 -2 -2,+4,+6 -2,+4,+6 -2,+4,+6 原子半径 逐渐增大 密度 逐渐增大 与 H2 化合难易 点燃剧烈反应 加热时化合 较高温度时化合 不直接化合 氢化物稳定性 逐渐减弱 氧化物化学式 —— SO2 SO3 SeO2 SeO3 TeO2 TeO3 氧化物对应水化物化学式 —— H2SO3 H2SO4 H2SeO3 H2SeO4 H2TeO3 H2TeO4 最高价氧化物水化物酸性 逐渐减弱 元素非金属性 逐渐减弱 2 .1 臭氧和过氧化氢 臭氧和氧气是氧的同素异形体,大气中臭氧层是人类的保护伞 过氧化氢不稳定分解,可作氧化剂、漂白剂。 归纳知识体系。 2.1.1.与氧气有关的反应 (1)有氧气参加的反应方程式 ① 与绝大多数金属单质作用 4Na+O2=2Na2O 2 ② 与绝大多数非金属单质作用 ③ 与非还原性化合物作用 2NO+O2=2NO2 4FeS2+11O22Fe2O2+8SO2 ④ 与有机物作用 ⑤ 在空气中易被氧化而变质的物质 a.氢硫酸或可溶性硫化物:2H2S+O2=2S↓+2H2O b.亚硫酸及其可溶性盐2H2SO3+O2=2H2SO4,2Na2SO3+O2=2Na2SO4 c.亚铁盐、氢氧化亚铁4Fe(OH)2+O2+2H2O=4Fe(OH)3 d.苯酚 e.氢碘酸及其可溶性碘化物4HI+O2=2H2O+2I2 ⑥ 吸氧腐蚀(如:铁生锈) 负极:2Fe— 4e—=2Fe2+ 正极:O2+4e—+2H2O=4OH— Fe2++2OH—=Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe(OH)3=Fe2O3+3H2O (2)生成氧气的反应方程式 3 2 .2 氧气和臭氧的比较 物质名称 臭 氧 氧 气 物理性质 通常状态 气 态 气 态 气 味 有刺激性臭味 无 味 熔点/℃ 约—251 约—218 沸点/℃ 约—112 约—183 颜 色 气态呈浅蓝色,液态呈深蓝色,固态呈紫黑色 气态无色,液态呈浅蓝色,固态仍呈浅蓝色 标况密度 g/L 2.143 1.429 溶解度 m L/L 494 30.8 主要化学性质 氧化性极强,可氧化 Ag、Hg 等 氧化性强,但难氧化 Ag、Hg 等 主要用途 漂白、消毒;地球上生物的天然保护伞;刺激中枢神经,加速血液循环 供给呼吸,支持燃烧 4 自...