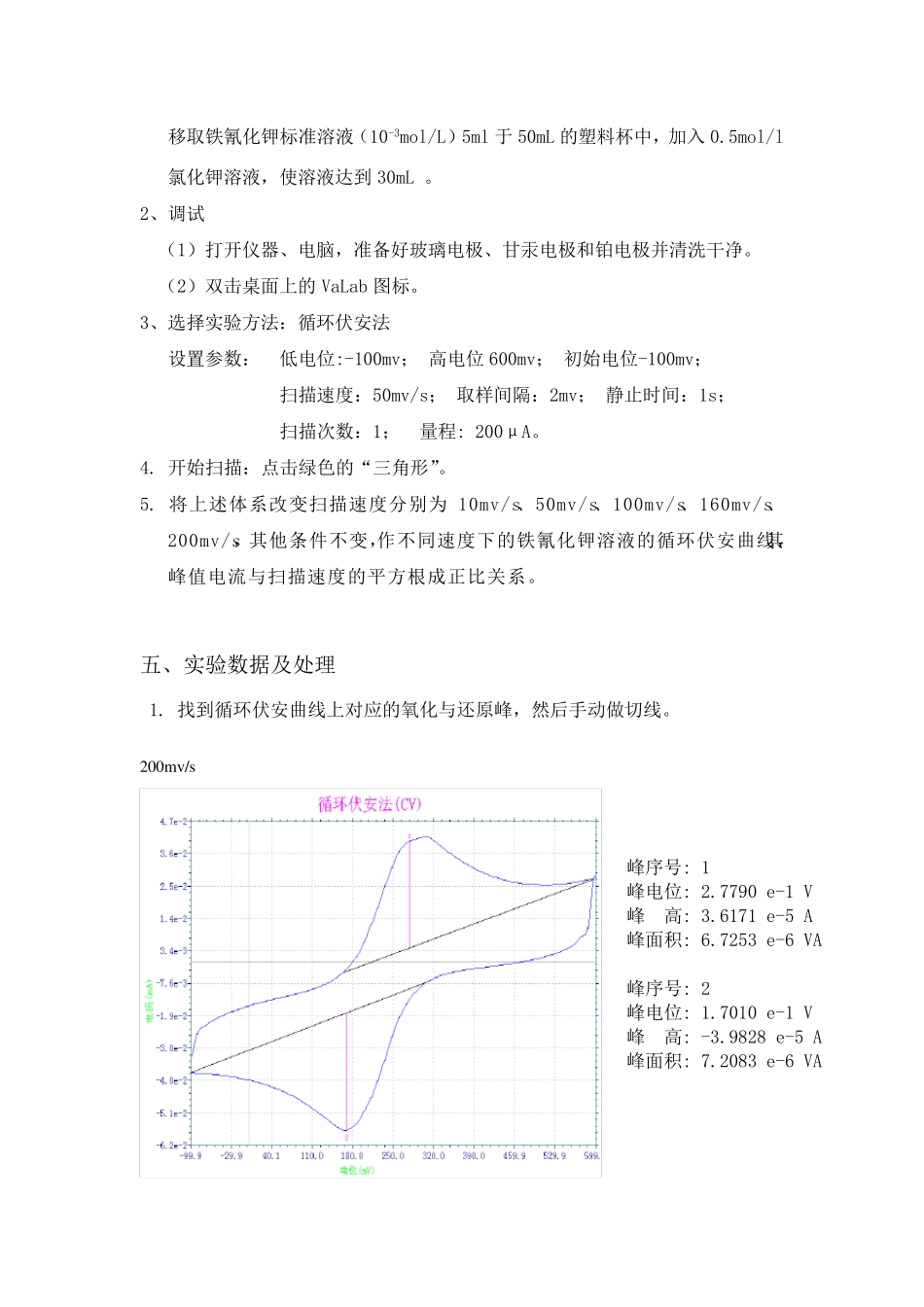
电化学分析实验报告 院系:化学化工学院 专业班级: 学号: 姓名: 同组者: 实验日期: 指导老师: 实验一:铁氰化钾在玻碳电极上的氧化还原 一、实验目的 1.掌握循环伏安扫描法。 2.学习测量峰电流和峰电位的方法。 二、实验原理 循环伏安法也是在电极上快速施加线性扫描电压,起始电压从Ei 开始,沿某一方向变化,当达到某设定的终止电压Em 后,再反向回扫至某设定的起始电压,形成一个三角波,电压扫描速率可以从每秒数毫伏到1V。 当溶液中存在氧化态物质Ox 时,它在电极上可逆地还原生成还原态物质,即 Ox + ne → Red;反向回扫时,在电极表面生成的还原态Red 则可逆地氧化成Ox,即 Red → Ox + ne.由此可得循环伏安法极化曲线。 在一定的溶液组成和实验条件下,峰电流与被测物质的浓度成正比。 从循环伏安法图中可以确定氧化峰峰电流Ipa、还原峰峰电流Ipc、氧化峰峰电位φpa和还原峰峰电位φpc。 对于可逆体系,氧化峰峰电流与还原峰峰电流比为:Ipa/Ipc =1 25℃时,氧化峰峰电位与还原峰峰电位差为:△φ=φpa- φpc≈56/z (mV) 条件电位为:φ=(φpa+ φpc)/2 由这些数值可判断一个电极过程的可逆性。 三、仪器与试剂 仪器::电化学分析仪 VA2020, 玻碳电极、甘汞电极、铂电极。 试剂:铁氰化钾标准溶液,0.5mol/l 氯化钾溶液,蒸馏水。 四、实验步骤 1、溶液的配制 移取铁氰化钾标准溶液(10-3mol/L)5ml 于50mL 的塑料杯中,加入0.5mol/l氯化钾溶液,使溶液达到30mL 。 2、调试 (1)打开仪器、电脑,准备好玻璃电极、甘汞电极和铂电极并清洗干净。 (2)双击桌面上的VaLab 图标。 3、选择实验方法:循环伏安法 设置参数: 低电位:-100mv; 高电位600mv; 初始电位-100mv; 扫描速度:50mv/s; 取样间隔:2mv; 静止时间:1s; 扫描次数:1; 量程: 200μA。 4. 开始扫描:点击绿色的“三角形”。 5. 将上述体系改变扫描速度分别为 10mv/s、50mv/s、100mv/s、160mv/s、200mv/s,其他条件不变,作不同速度下的铁氰化钾溶液的循环伏安曲线,其峰值电流与扫描速度的平方根成正比关系。 五、实验数据及处理 1. 找到循环伏安曲线上对应的氧化与还原峰,然后手动做切线。 200mv/s 峰序号: 1 峰电位: 2.7790 e-1 V 峰 高: 3.6171 e-5 A 峰面积: 6.7253 e-6 VA 峰序号: 2 峰电位: 1.7010 e-1 V 峰 高: -3.9828 e-5 A 峰面积: 7.2083 e-6...