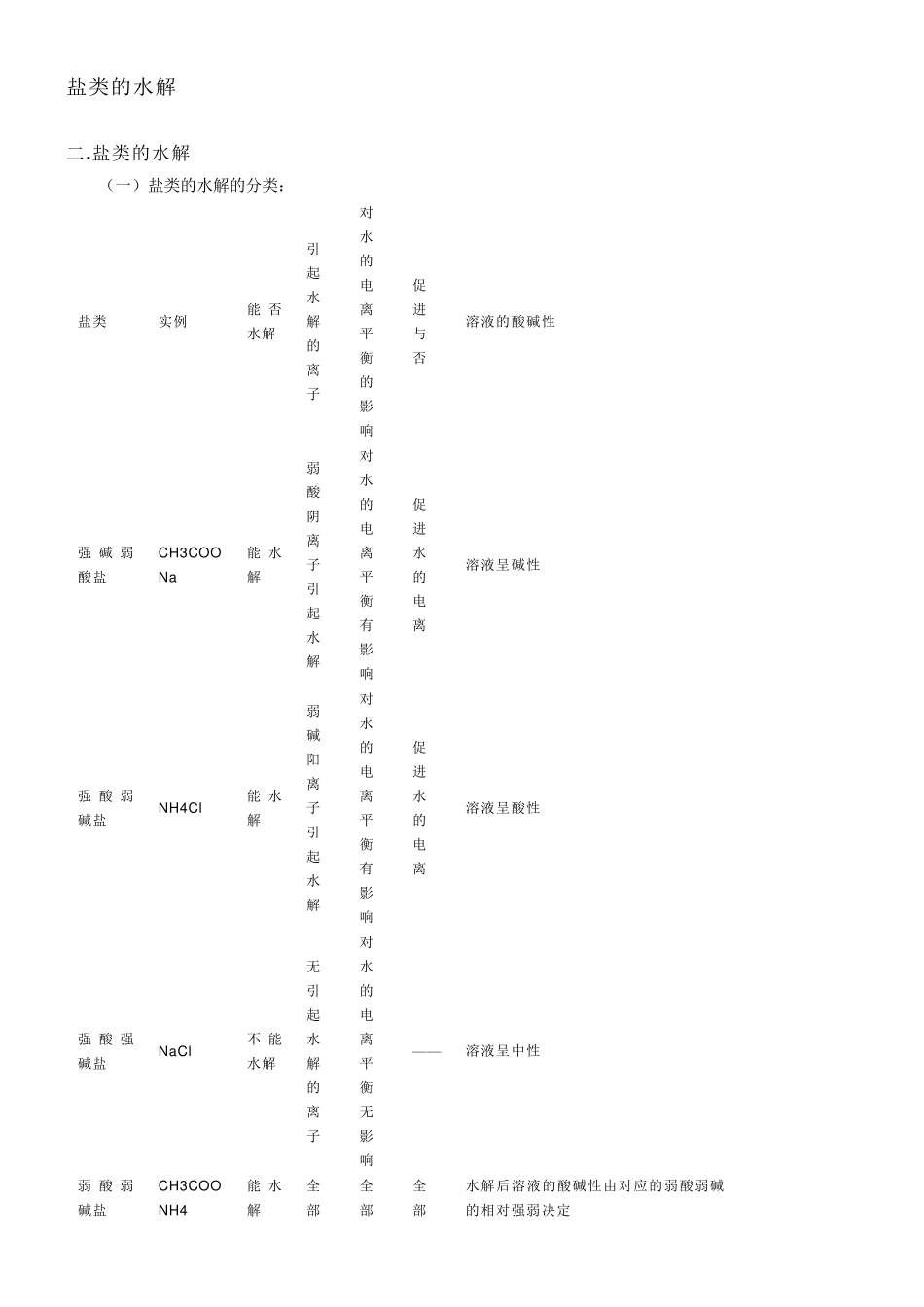
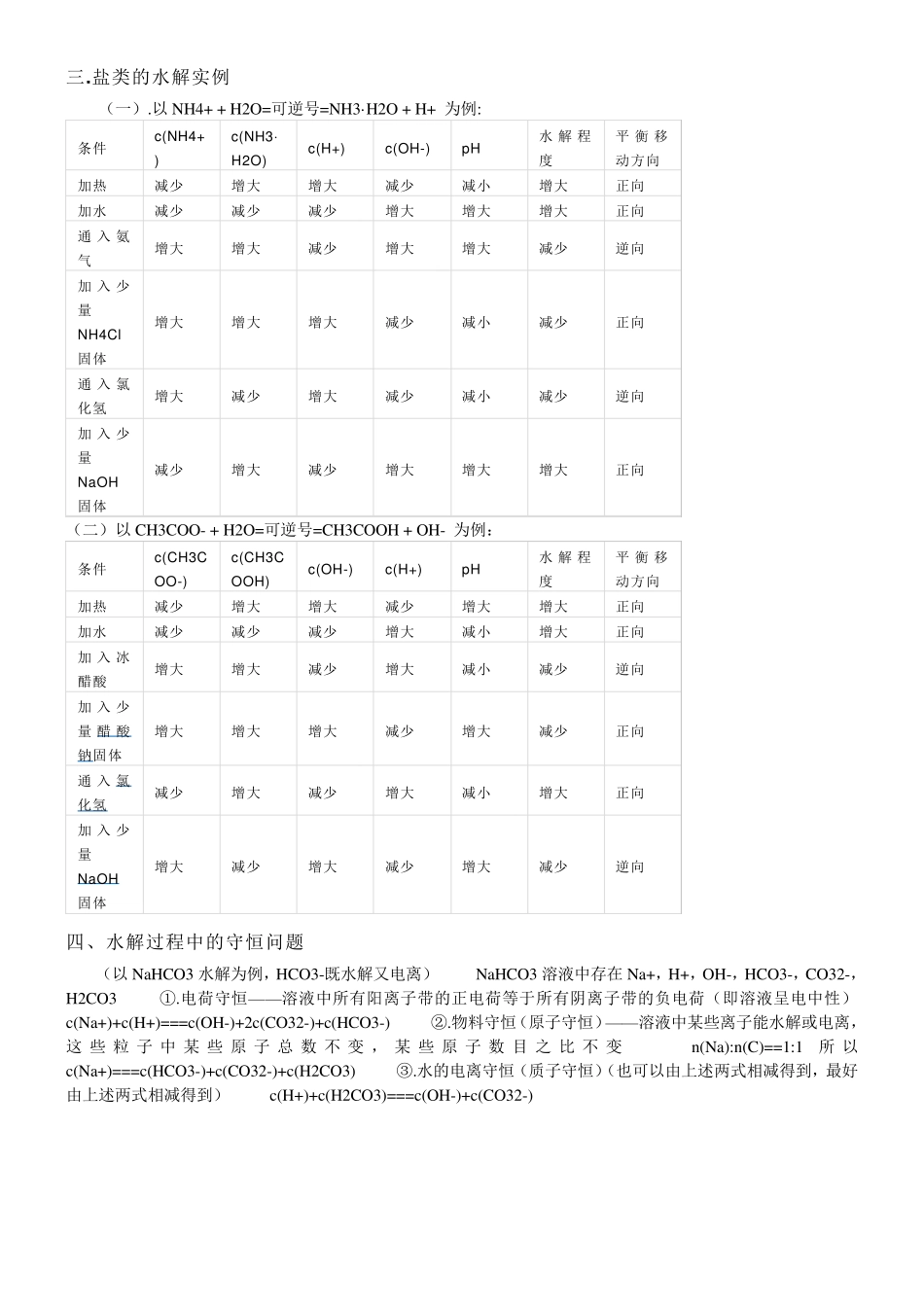
盐类的水解 二.盐类的水解 (一)盐类的水解的分类: 盐类 实例 能 否水解 引起水解的离子 对水的电离平衡的影响 促进与否 溶液的酸碱性 强 碱 弱酸盐 CH3COONa 能 水解 弱酸阴离子引起水解 对水的电离平衡有影响 促进水的电离 溶液呈碱性 强 酸 弱碱盐 NH4Cl 能 水解 弱碱阳离子引起水解 对水的电离平衡有影响 促进水的电离 溶液呈酸性 强 酸 强碱盐 NaCl 不 能水解 无引起水解的离子 对水的电离平衡无影响 —— 溶液呈中性 弱 酸 弱碱盐 CH3COONH4 能 水解 全部 全部 全部 水解后溶液的酸碱性由对应的弱酸弱碱的相对强弱决定 一 .定 义 在 溶 液 中 , 强 碱 弱 酸 盐 , 强 酸 弱 碱 盐 或 弱 酸 弱 碱 盐 电 离 出 来 的 离 子 与 水 电 离 出 来 的 H+与 OH-生 成 弱 电 解 质的 过 程 叫 做 盐 类 水 解 越 弱 越 水 解 酸 性 溶 液 ph 越 小 越 水 解 , 碱 性 溶 液 ph 越 大 越 水 解 ( 二 ) 盐 类 水 解 的 类 型 类 型 酸 碱 性 PH 举 例 强酸弱碱盐水解 溶液显酸 性 p H<7 NH4Cl、AlCl3 、FeCl3、Cu SO4等 强碱弱酸盐水解 溶液显碱 性 p H>7 CH3COONa 、Na2CO3、Na2S等 强酸强碱盐水解 溶液显中 性 p H=7 KCl、NaCl 、Na2SO4等 弱酸弱碱盐水解 水解后溶液的酸碱性由对应的弱酸弱碱的相对强弱 决 定 —— CH3COONH4等 ( 三 ) 相 关 内 容 1.实 质 : 弱 电 解 质 的 生 成 , 破 坏 了 水 的 电 离 , 促 进 水 的 电 离 平 衡 发 生 移 动 的 过 程 。 2.规 律 : 难 溶 不 水 解 , 有 弱 才 水 解 , 无 弱 不 水 解 ; 谁 弱 谁 水 解 , 越 弱 越 水 解 , 都 弱 都 水 解 ; 谁 强 显 谁 性 , 同 强 显 中性 , 弱 弱 具 体 定 ; 越 热 越 水 解 , 越 稀 越 水 解 。 ( 即 盐 的 构 成 中 出 现 弱 碱 阳 离 子 或 弱 酸 根 阴 离 子 , 该 盐 就 会水 解 ; 这 些 离 子 对 应 的 碱 或 酸 越 弱 , 水 解 程 度 越 大 , 溶 液 的 pH 变 化 越 大 ; 水 解 后 溶 液 的 酸 碱 性 由 构 成 该 盐 离 子对 应 的 酸 和 碱 相 对...