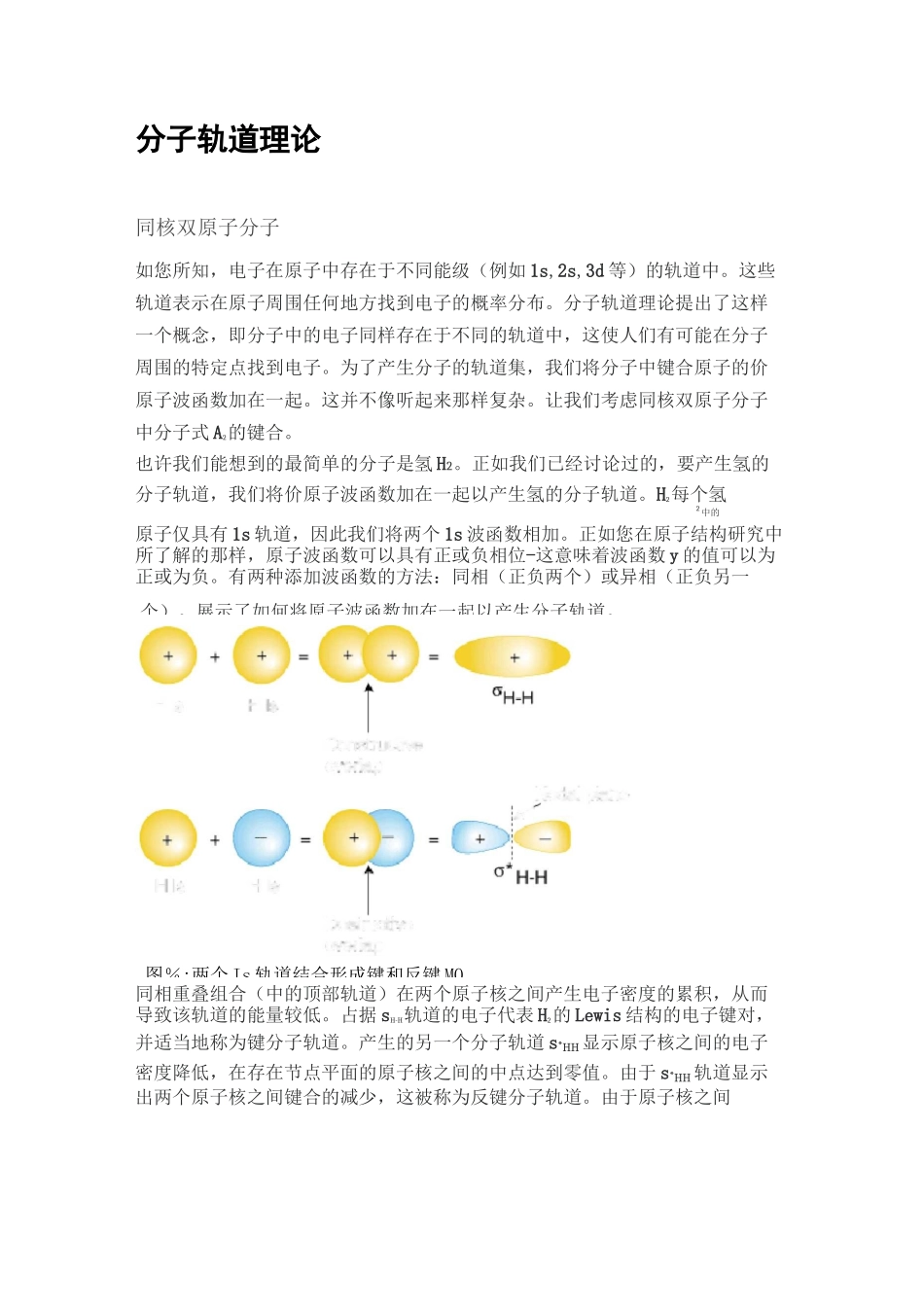
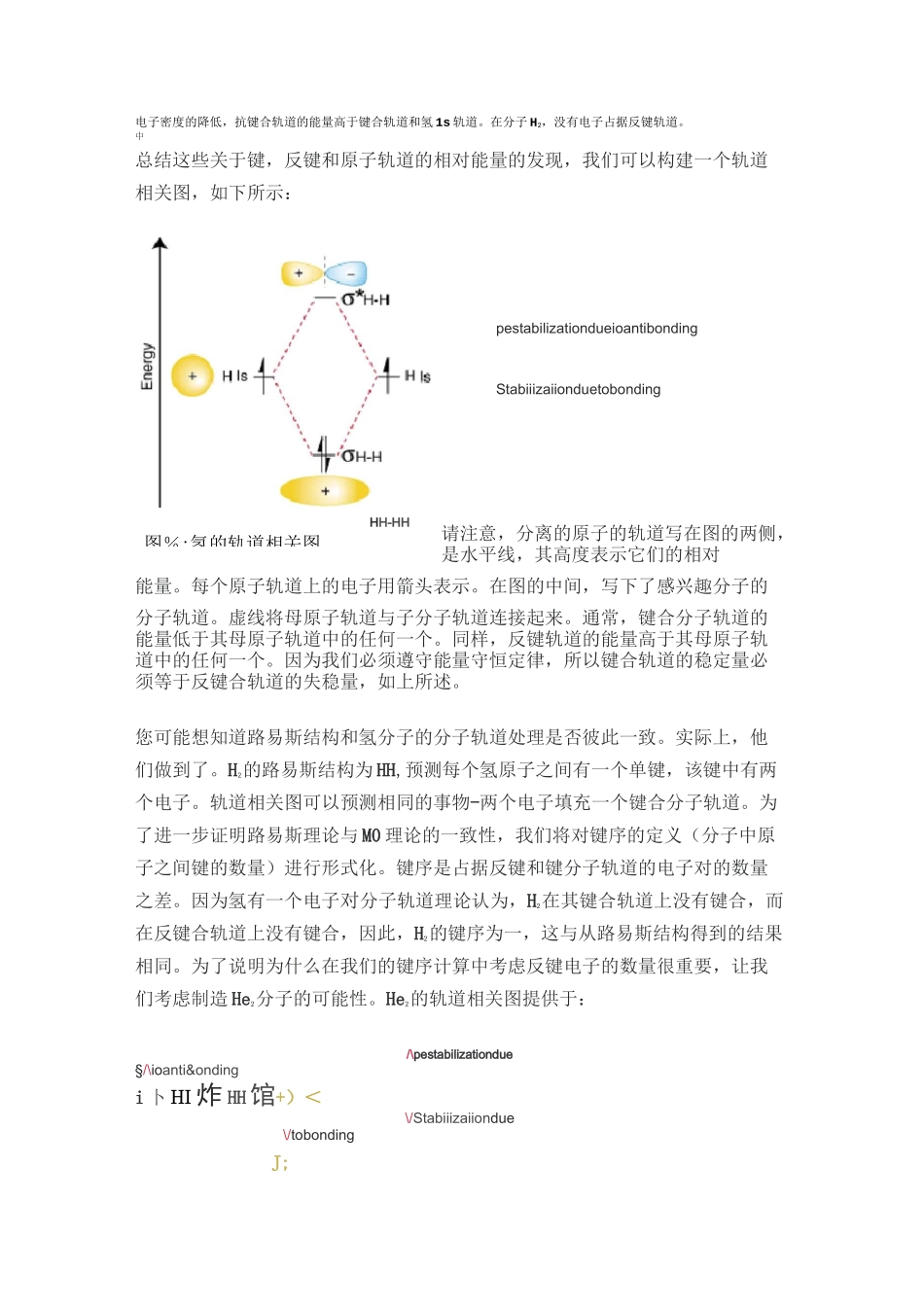
个)。展示了如何将原子波函数加在一起以产生分子轨道。H IHisHIsHI^NodalplaneConstructiveoverlaDestructiveoverl图%:两个 Is 轨道结合形成键和反键 MO分子轨道理论同核双原子分子如您所知,电子在原子中存在于不同能级(例如 1s,2s,3d 等)的轨道中。这些轨道表示在原子周围任何地方找到电子的概率分布。分子轨道理论提出了这样一个概念,即分子中的电子同样存在于不同的轨道中,这使人们有可能在分子周围的特定点找到电子。为了产生分子的轨道集,我们将分子中键合原子的价原子波函数加在一起。这并不像听起来那样复杂。让我们考虑同核双原子分子中分子式 A2的键合。也许我们能想到的最简单的分子是氢 H2。正如我们已经讨论过的,要产生氢的分子轨道,我们将价原子波函数加在一起以产生氢的分子轨道。H2每个氢2中的原子仅具有 1s 轨道,因此我们将两个 1s 波函数相加。正如您在原子结构研究中所了解的那样,原子波函数可以具有正或负相位-这意味着波函数 y 的值可以为正或为负。有两种添加波函数的方法:同相(正负两个)或异相(正负另一同相重叠组合(中的顶部轨道)在两个原子核之间产生电子密度的累积,从而导致该轨道的能量较低。占据 sH-H轨道的电子代表 H2的 Lewis 结构的电子键对,并适当地称为键分子轨道。产生的另一个分子轨道 s*HH 显示原子核之间的电子密度降低,在存在节点平面的原子核之间的中点达到零值。由于 s*HH 轨道显示出两个原子核之间键合的减少,这被称为反键分子轨道。由于原子核之间电子密度的降低,抗键合轨道的能量高于键合轨道和氢 1s 轨道。在分子 H2,没有电子占据反键轨道。中总结这些关于键,反键和原子轨道的相对能量的发现,我们可以构建一个轨道相关图,如下所示:pestabilizationdueioantibondingStabiiizaiionduetobonding请注意,分离的原子的轨道写在图的两侧,是水平线,其高度表示它们的相对能量。每个原子轨道上的电子用箭头表示。在图的中间,写下了感兴趣分子的分子轨道。虚线将母原子轨道与子分子轨道连接起来。通常,键合分子轨道的能量低于其母原子轨道中的任何一个。同样,反键轨道的能量高于其母原子轨道中的任何一个。因为我们必须遵守能量守恒定律,所以键合轨道的稳定量必须等于反键合轨道的失稳量,如上所述。您可能想知道路易斯结构和氢分子的分子轨道处理是否彼此一致。实际上,他们做到了。H2的路易斯结构为 HH,预测每个氢原子之间有一个单键,该键中有两...