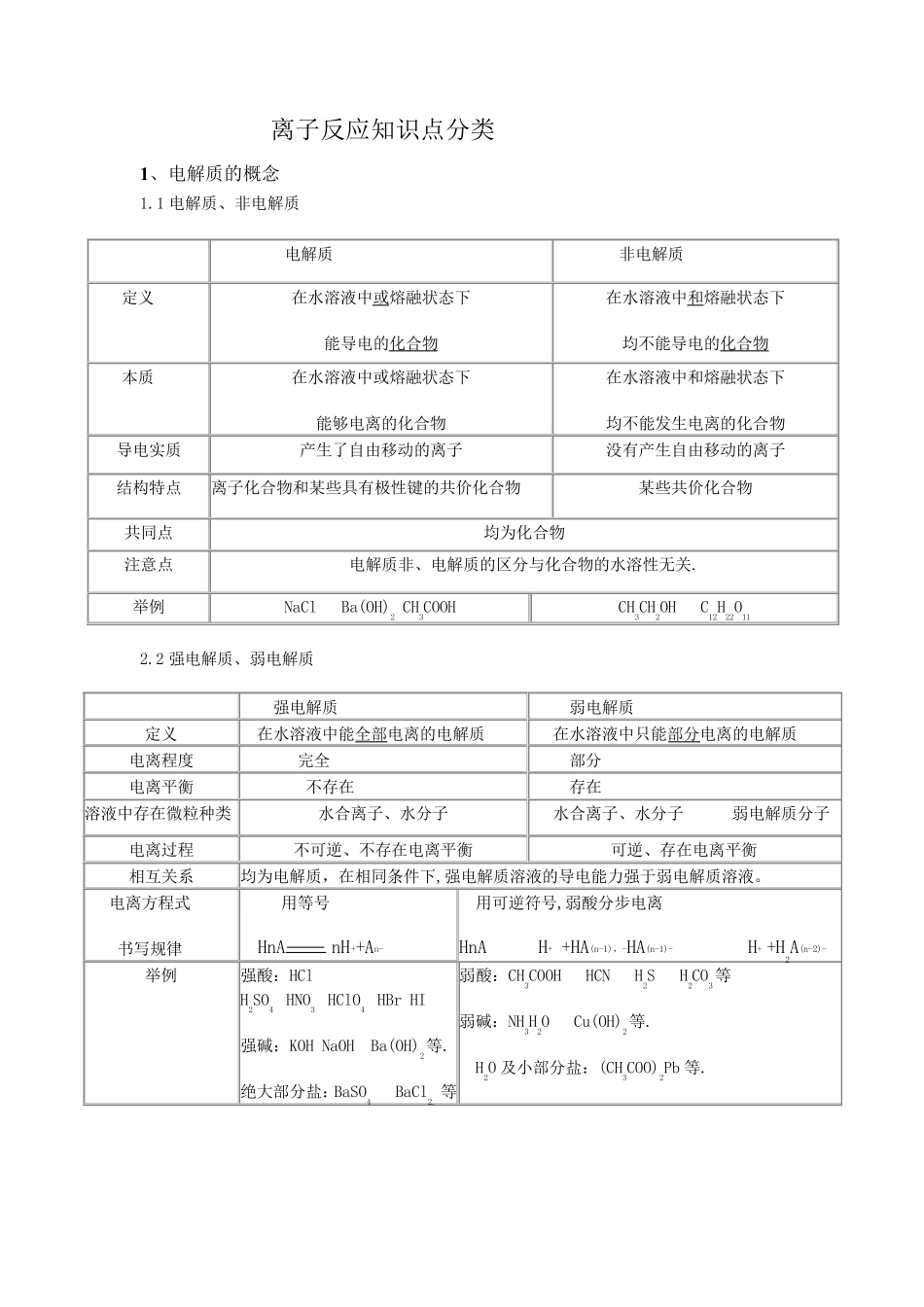
离子反应知识点分类 1、电解质的概念 1.1 电解质、非电解质 电解质 非电解质 定义 在水溶液中或熔融状态下 能导电的化合物 在水溶液中和熔融状态下 均不能导电的化合物 本质 在水溶液中或熔融状态下 能够电离的化合物 在水溶液中和熔融状态下 均不能发生电离的化合物 导电实质 产生了自由移动的离子 没有产生自由移动的离子 结构特点 离子化合物和某些具有极性键的共价化合物 某些共价化合物 共同点 均为化合物 注意点 电解质非、电解质的区分与化合物的水溶性无关. 举例 NaCl Ba(OH)2 CH3COOH CH3CH2OH C12H22O11 2.2 强电解质、弱电解质 强电解质 弱电解质 定义 在水溶液中能全部电离的电解质 在水溶液中只能部分电离的电解质 电离程度 完全 部分 电离平衡 不存在 存在 溶液中存在微粒种类 水合离子、水分子 水合离子、水分子 弱电解质分子 电离过程 不可逆、不存在电离平衡 可逆、存在电离平衡 相互关系 均为电解质,在相同条件下,强电解质溶液的导电能力强于弱电解质溶液。 电离方程式 书写规律 用等号 HnA nH++An- 用可逆符号,弱酸分步电离 HnA H+ +HA(n-1),-HA(n-1)- H+ +H2A(n-2)- 举例 强酸:HCl H2SO4 HNO3 HClO4 HBr HI 强碱:KOH NaOH Ba(OH)2等. 绝大部分盐:BaSO4 BaCl2. 等 弱酸:CH3COOH HCN H2S H2CO3等 弱碱:NH3H2O Cu(OH)2等. H2O 及小部分盐:(CH3COO)2Pb 等. 2、离子反应及离子反应方程式 离子反应定义:在反应中有离子参加或有离子生成的反应称为离子反应。(在中学阶段仅限于在溶液中进行的反应,可以说离子反应是指在水溶液中有电解质参加的一类反应。因为电解质在水溶液里发生的反应,其实质是该电解质电离出的离子在水溶液中的反应。) 2.1 离子反应的分类与条件 离子反应类型 一.非氧化还原反应的离子反应 反应发生条件: ①生成难溶的物质。如生成BaSO4、AgCl、CaCO3 等。 ②生成难电离的物质。如生成CH3COOH、H2O、NH3•H2O、HClO 等。 ③ 生成挥 发性 物质。如生成CO2、SO2、H2S 等 这 类反应的共 同 特 征 是朝 着 离子浓 度 减 小 的方向 移 动 或者 说反应物中某 种 离子的浓 度 减 小 ,反应即 可发生。 (1) 酸 碱 盐 之 间 的复 分解反应 a 中和 反应,根 据 参加反应的酸 和 碱 的性 质不 同 ,又 可分为强 酸 与强 碱 、强 碱 与弱 酸 、强 ...