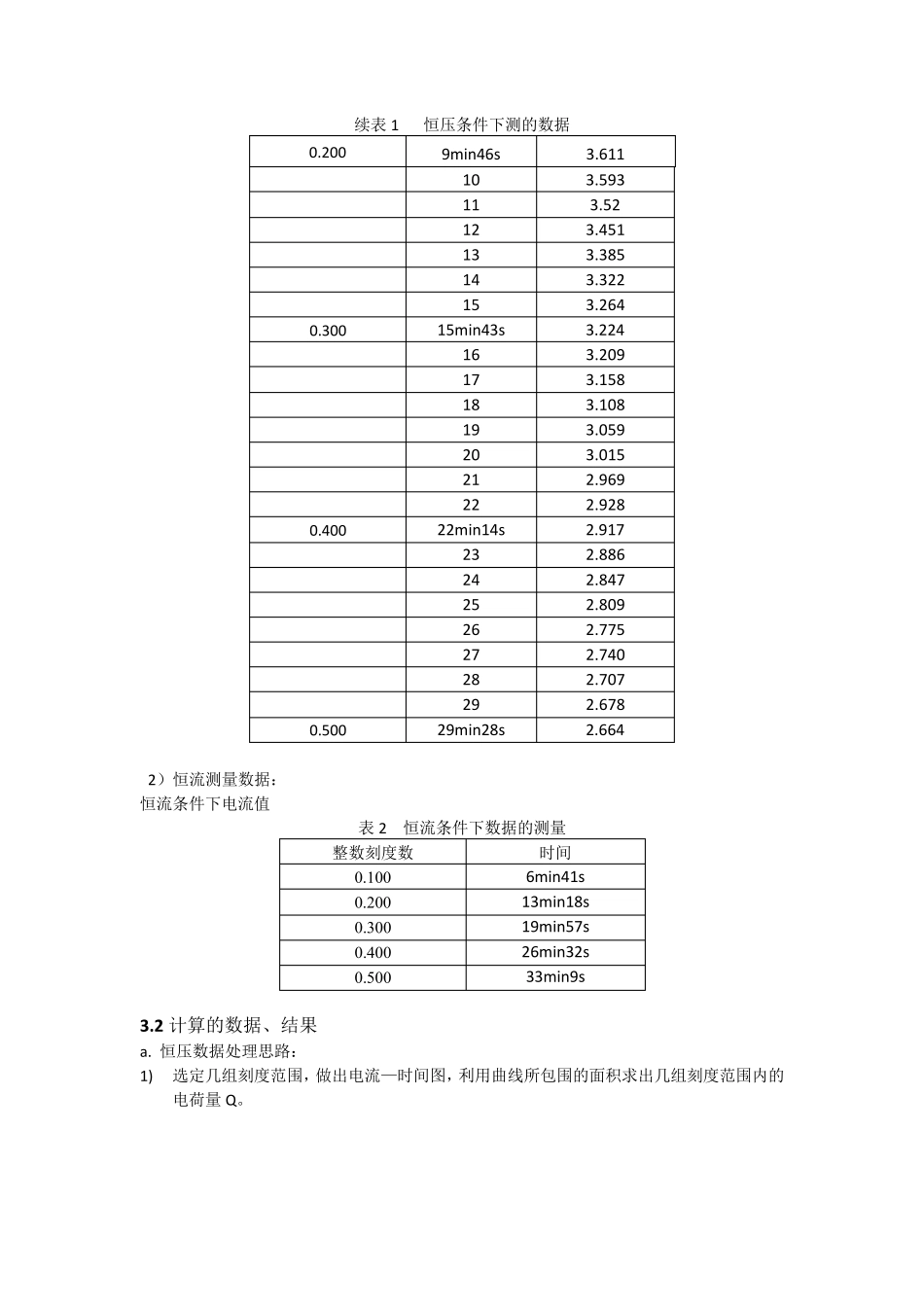
离子迁移数的测定——界面法 姓名:张冶 学号: 班级:化21 同组实验者:努尔艾力·麦麦提 实验日期:2014 年 12 月 4 日 提交报告日期:2014 年 12 月 7 日 实验助教:王溢磊 1 引言 1.1 实验目的 1.采用界面法测定H+离子的迁移数。 2.掌握测定离子迁移数的基本原理与方法。 1.2 实验原理[1] 当电流通过电解池溶液时,电极上发生化学变化,溶液中阳离子与阴离子分别向阴极和阳极迁移。若两种离子传递的电荷量分别为 q+和 q-,通过的总电荷量为 Q = ᵅ++ᵅ− 每种离子传递的电荷量与总电荷量之比称为离子迁移数,则阴、阳离子的迁移数分别为 ᵆ−= ᵅ−Q ᵆ+= ᵅ+Q 且 ᵆ++ᵆ−= 1 在包含数种电解质的溶液中,t-和 t+分别为所有阴、阳离子迁移数总和,一般增加某种离子浓度,其离子迁移数增加;对只含一种电解质的溶液,浓度的改变使离子间引力场改变,自然离子迁移数也改变;若温度改变,迁移数亦变化,一般温度升高时,t-和 t+差别减小。 实验中采用界面法,以镉离子作为指示离子,测量一定浓度的盐酸溶液中 H+离子迁移数。在一截面均匀的垂直放置的迁移管中充满盐酸溶液,通以电流,当有 Q 电量的电流通过每个静止的截面时,t+Q 当量的H+上行,t-Q 当量的Cl-通过界面下移。假定在管的下部某处存在一个界面,界面以下没有 H+而被Cd2+取代 ,此 界面将 随 H+的上移而移动 ,界面位 置可 利 用界面上下溶液 p H 值 的不 同,使用指示剂 显 色 。正 常 条 件 下界面保 持 清 晰 ,界面以上的一段 溶液保 持 均匀,H+向上迁移的平 均速 率 等 于 界面上移速 率 。在某通电时间 t内 ,界面扫 过体 积 V,H+输 送 电荷数为该 体 积 中 H+带 电总数,即 ᵅ+= ᵄᵃᵃ 式 中:C 为 H+的浓度,F 为法拉 第 常 数,电荷量以库 [仑 ](C)计 。 要 想 使界面保 持 清 晰 ,须 使界面上、下的电解质不 相 混 合 ,这 可通过选 择 合 适 的指示离子在通电情 况 下达 到 ,Cd2+就 符 合 这 个要 求 。Cd2+的淌 度(U)较 小,有 ᵄCd2+ < ᵄH+ 通电时,H+上行Cl-下移,Cd 在 Cd 电极上氧 化并 经 入 溶液中生成 CdCl2,逐 渐 顶 替 HCl,在管内 形 成 界面。由 于 溶液呈 电中性 ,任意 截面都 不 会 中断 传递电流,H+迁移走 后 Cd2+紧 随 其后 且两者迁移速率 相 等 ,则 ᵄCd2+...