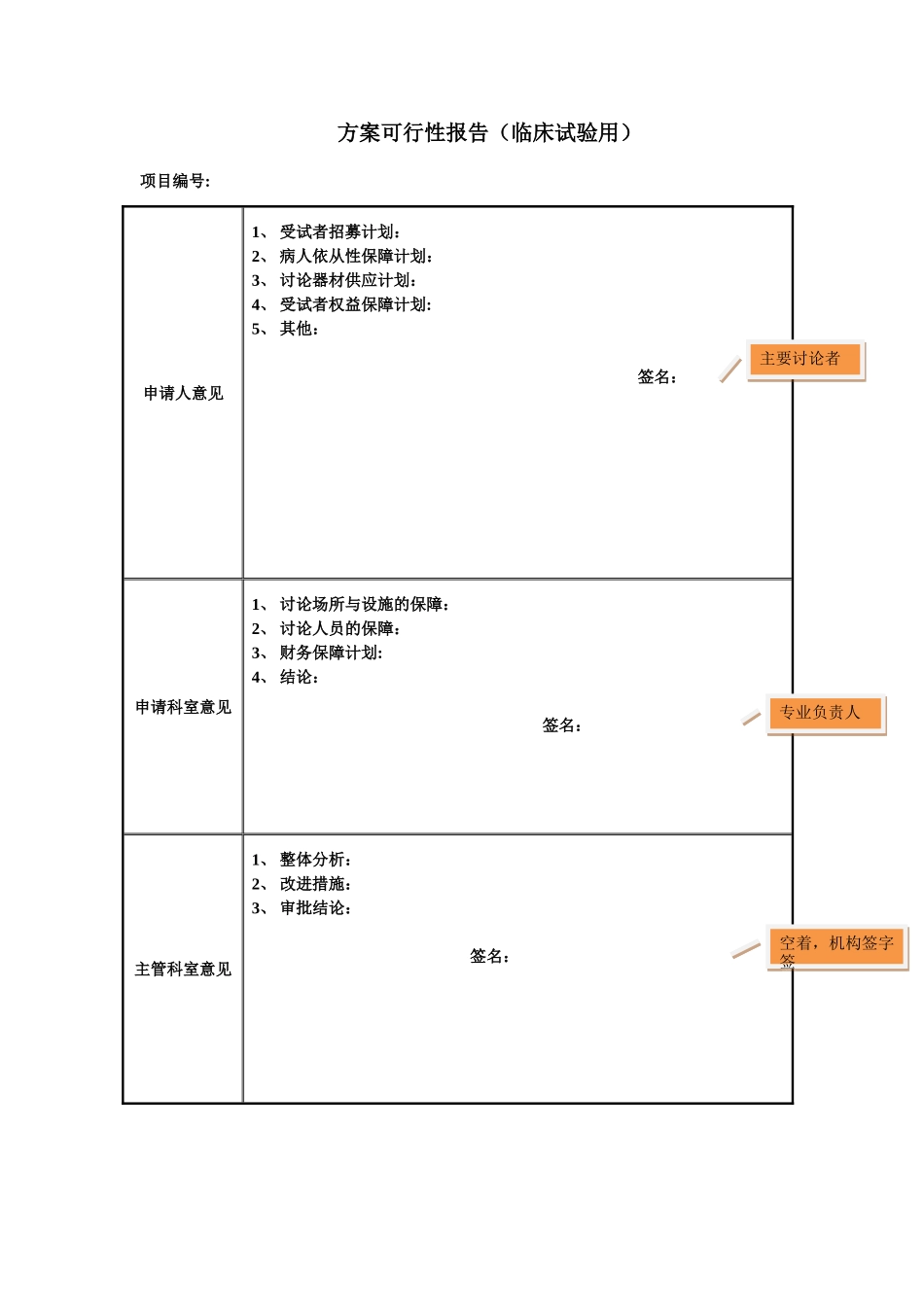
申请编号(机构编写): 递交日期: 年 月 日医疗器械临床试验申请书□ 普通申请□ 加速申请复旦大学附属上海市第五人民医院药物临床试验机构主任:现有一项医疗器械拟在我院进行临床讨论,题目为:器械名称: 试验类别:□第二类 □第三类 申办公司名称CRO 名称申办公司地址CRO 地址申办者代表电话CRO 代表电话附件材料(请逐项核实)1.申办者(和 CRO)资质证明(如企业三证) □2.CRA 资质证明(包括委托书、简历和 GCP 证书) □3.CFDA 临床试验批件(如为第三类医疗器械) □4.组长单位伦理委员会批件(如为多中心试验) □5.讨论者手册(包括说明书等相关讨论参考资料) □6.临床试验方案(最新,版本号: ) □7.知情同意书包括患者须知(最新,版本号: ) □8.病例报告表和讨论病历(如适用) □9.试验用医疗器械的自检报告 □10. 试验用医疗器械合格的检验报告 □11. 讨论小组成员名单和履历(本院) □12. 试验用医疗器械研制符合适用的医疗器械生产质量管理法律规范声明 □13. 其他(如适用) □主要讨论者意见: 主要讨论者签名: 日期: 年 月 日专业负责人意见: 专业负责人签名: 日期: 年 月 日填表说明:1.该表格由专业负责人进行填写。2.用黑色或蓝黑色钢笔填写此表,字迹要清楚、工整,不得涂改;同时支持电子打印(签字需手写)。3.如有□请在相应栏目上画 X。4.CRO 指提供临床试验服务的合同讨论公司。5.表中假如栏目填写不下时,请在“其他”项下添加。 方案可行性报告(临床试验用)项目编号: 申请人意见1、 受试者招募计划: 2、 病人依从性保障计划: 3、 讨论器材供应计划: 4、 受试者权益保障计划: 5、 其他: 签名: 申请科室意见1、 讨论场所与设施的保障: 2、 讨论人员的保障: 3、 财务保障计划: 4、 结论: 签名: 主管科室意见1、 整体分析: 2、 改进措施: 3、 审批结论: 签名: 主要讨论者主要讨论者专业负责人专业负责人空着,机构签字签空着,机构签字签