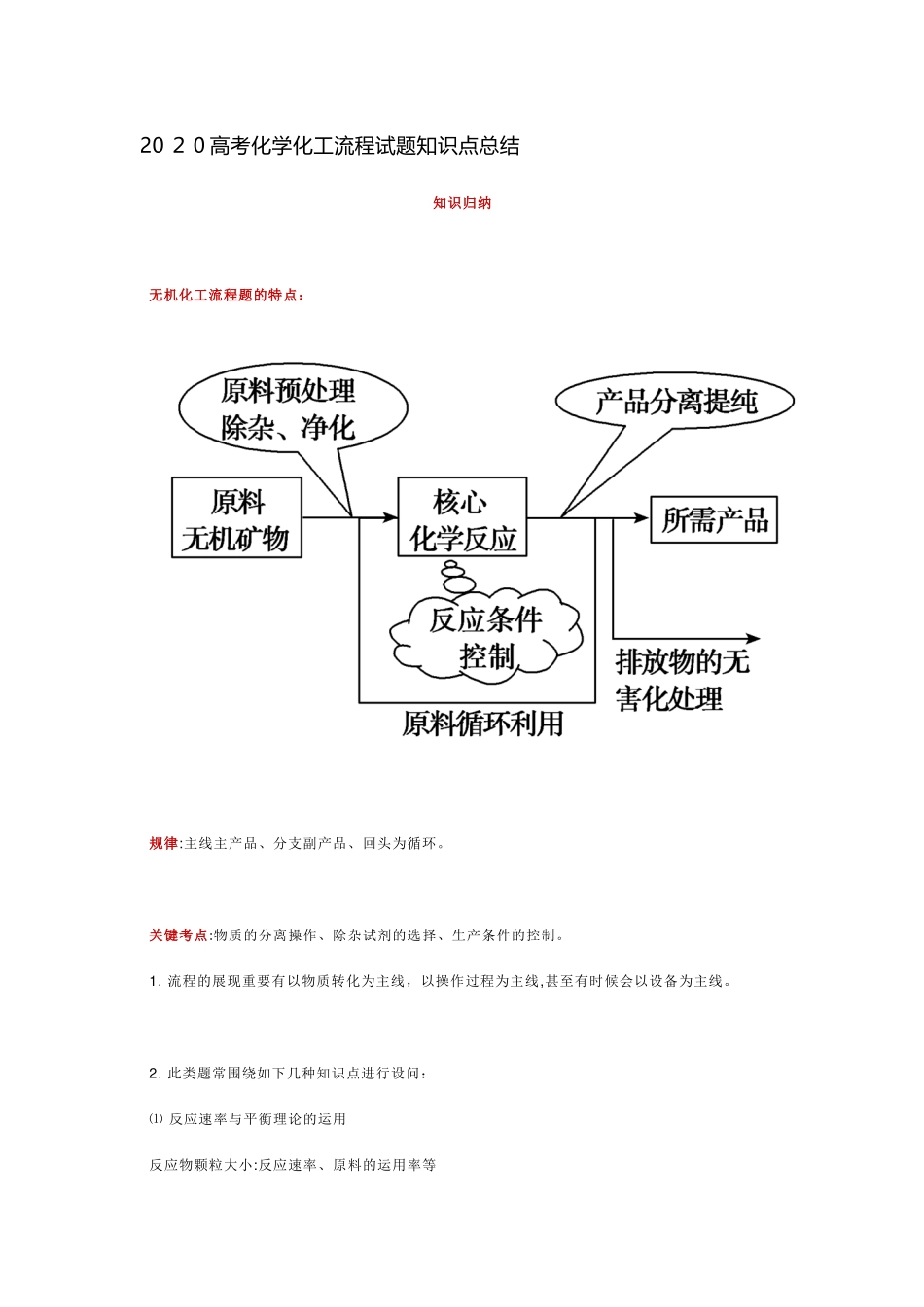
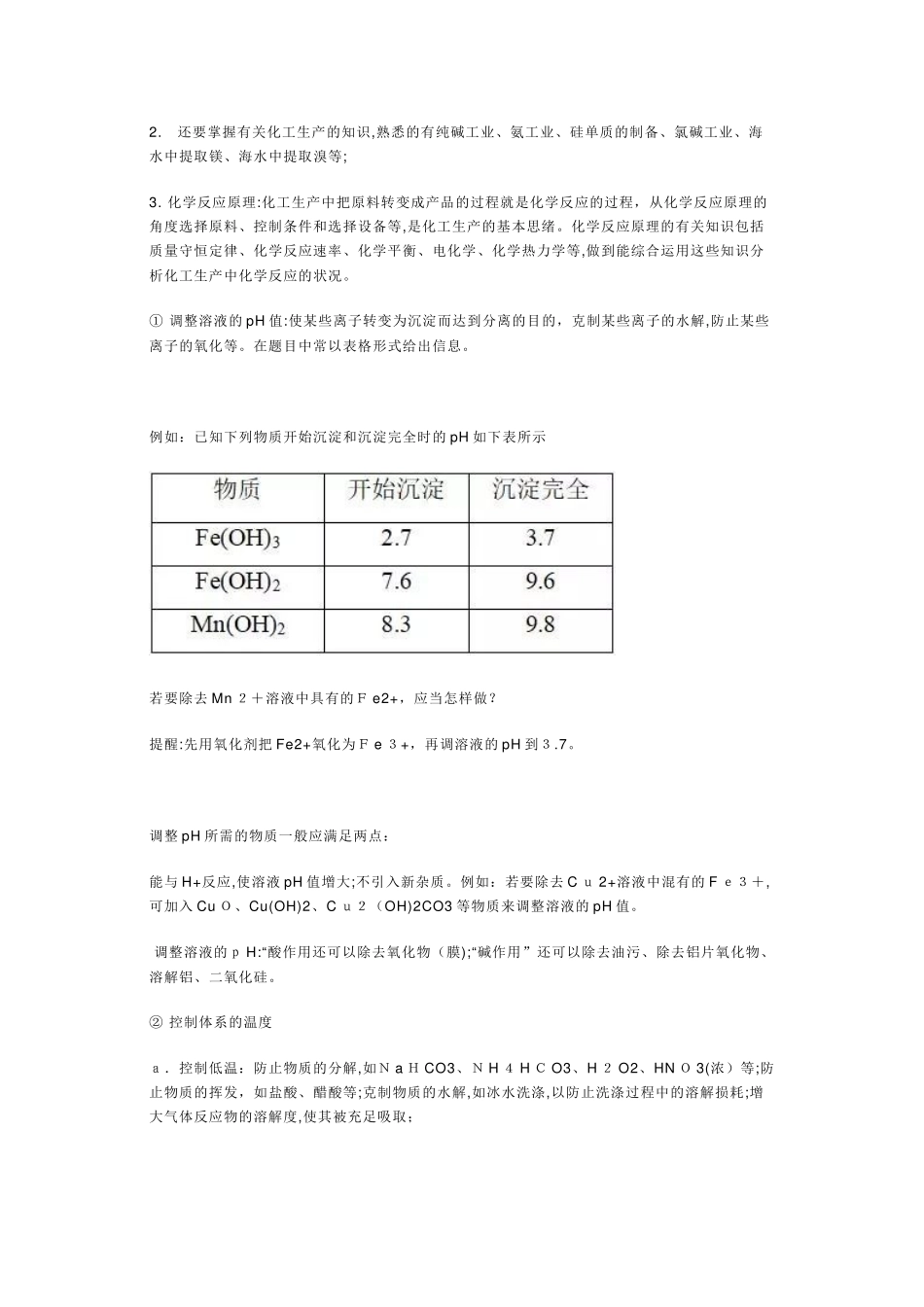
20 2 0 高考化学化工流程试题知识点总结知识归纳无机化工流程题的特点:规律:主线主产品、分支副产品、回头为循环。关键考点:物质的分离操作、除杂试剂的选择、生产条件的控制。1. 流程的展现重要有以物质转化为主线,以操作过程为主线,甚至有时候会以设备为主线。2. 此类题常围绕如下几种知识点进行设问:⑴ 反应速率与平衡理论的运用 反应物颗粒大小:反应速率、原料的运用率等温度:反应速率、物质的稳定性、物质的结晶等⑵ 氧化还原反应的判断、化学方程式或离子方程式的书写;⑶ 运用控制p H 分离除杂;⑷ 化学反应的能量变化;⑸ 试验基本操作:除杂、分离、检查、洗涤、干燥等;⑹ 流程中的物质转化和循环,资源的回收和运用;⑺ 环境保护与绿色化学评价。一、原料处理的措施和作用对原料进行预处理的常用措施及其作用:1. 粉碎、研磨:减小固体的颗粒度,增大固体与液体或气体间的接触面积,加紧反应速率。2. 水浸:与水接触反应或溶解。3. 酸浸:一般用酸溶,如用硫酸、盐酸、浓硫酸等,与酸接触反应或溶解,使可溶性金属离子进入溶液,不溶物通过过滤除去。近年来,在高考题出现了“浸出”操作。在化工生产题中,矿物原料“浸出”的任务是选择合适的溶剂,使矿物原料中的有用组分或有害杂质选择性地溶解,使其转入溶液中,达到有用组分与有害杂质或与脉石组分相分离的目的。4. 浸出率:固体溶解后,离子在溶液中含量的多少(更多转化)。5. 灼烧:除去可燃性杂质或使原料初步转化,如从海带中提取碘时的灼烧就是为了除去可燃性杂质,将有机碘转化为碘盐。6. 灼烧、焙烧、煅烧:变化构造和构成,使某些物质能溶解;并使某些杂质在高温下氧化、分解,如煅烧高岭土和石灰石。二、掌握关键化学反应1. 元素及其化合物知识:化工生产将原料转变成产品的过程,也是物质经历互相转化的过程。理解物质之间的转化关系,就要用到元素及其化合物的有关知识。一般围绕铁、铜、铝、镁、氯、硫、磷、硅等元素的单质或化合物的工业制备来进行命题,需要掌握这些元素及其化合物的知识2. 还要掌握有关化工生产的知识,熟悉的有纯碱工业、氨工业、硅单质的制备、氯碱工业、海水中提取镁、海水中提取溴等;3. 化学反应原理:化工生产中把原料转变成产品的过程就是化学反应的过程,从化学反应原理的角度选择原料、控制条件和选择设备等,是化工生产的基本思绪。化学反应原理的有关知识包括质量守恒定律、化学反应速率、化学平衡、电化学、化学热力学等,做到...