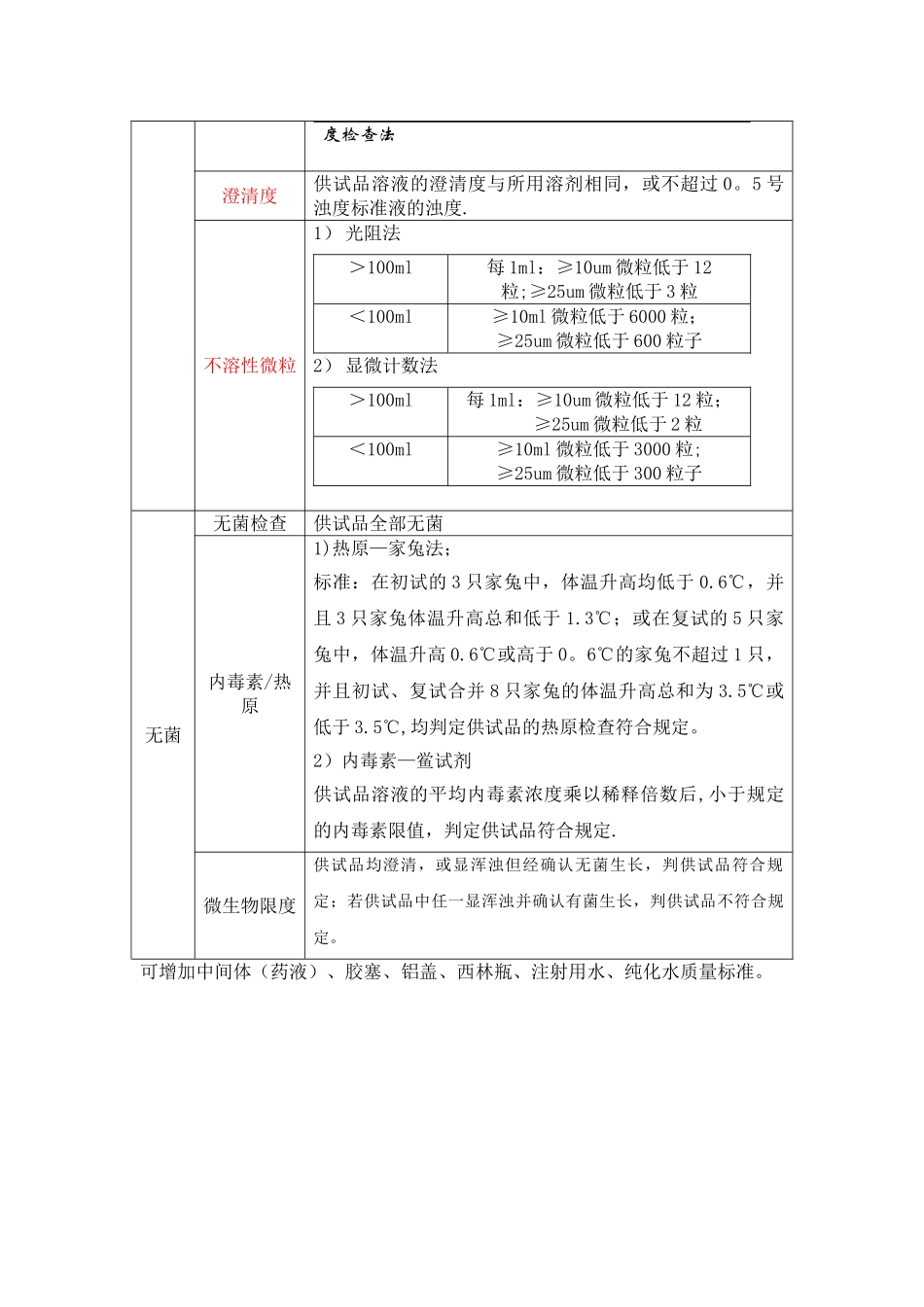
注射剂质量检查项目项目名称检查方法概述理化性状符合药品外观描述pHpH 测定仪测量,符合药品 pH 范围含量检测HPLC 测定 API 浓度符合要求鉴别API 专属性鉴别有关物质HPLC 测定有关物质,对比杂质面积值水分水分测定低于标准值残留溶剂符合法规、工艺要求干燥失重除规定外,105℃干燥至恒重,减少重量低于 x%。重金属及有害金属灼烧后颜色比较,低于标准液颜色深度/含量低于某值异常毒性渗透压装量(选一做)装量(注射剂)每支的装量均不得少于其标示量装量差异注射用无菌粉末平均装量装量差异限度0。05g 及 0.05g 以下±15%0。05g—0.15g±10%0。15g—0.50g±7%0。50g 以上±5%凡规定检查含量均匀度的注射用无菌粉末,一般不再进行装量差异检查.摘至《2024 年药典》第二部 P1264,附录 I B 注射剂含量均匀度每片/个标示量不大于 25mg 或主要含量不大于每片/个重量 25%。摘至 2024 版《药典》第二部 P1347 ,附录 X E 含量均匀度检查法微粒可见异物1)注射剂、滴眼剂20 支不得检出可见异物;2)注射用无菌粉末类别可见异物限度化学药≤4 个生 化 药 、抗 生 素 药和重要≥2g≤10 个<2g≤8 个3)无菌原料药类别可见异物限度化学药≤2 个生化药、抗生素药和中药≤5 个摘至《2024 年药典》第 2 部,P1329,附录 I B 澄清度检查法澄清度供试品溶液的澄清度与所用溶剂相同,或不超过 0。5 号浊度标准液的浊度.不溶性微粒1) 光阻法>100ml每 1ml:≥10um 微粒低于 12粒;≥25um 微粒低于 3 粒<100ml≥10ml 微粒低于 6000 粒;≥25um 微粒低于 600 粒子2) 显微计数法>100ml每 1ml:≥10um 微粒低于 12 粒; ≥25um 微粒低于 2 粒<100ml≥10ml 微粒低于 3000 粒;≥25um 微粒低于 300 粒子无菌无菌检查供试品全部无菌内毒素/热原1)热原—家兔法;标准:在初试的 3 只家兔中,体温升高均低于 0.6℃,并且 3 只家兔体温升高总和低于 1.3℃;或在复试的 5 只家兔中,体温升高 0.6℃或高于 0。6℃的家兔不超过 1 只,并且初试、复试合并 8 只家兔的体温升高总和为 3.5℃或低于 3.5℃,均判定供试品的热原检查符合规定。2)内毒素—鲎试剂供试品溶液的平均内毒素浓度乘以稀释倍数后,小于规定的内毒素限值,判定供试品符合规定.微生物限度供试品均澄清,或显浑浊但经确认无菌生长,判供试品符合规定;若供试品中任一显浑浊并确认有菌生长,判供试品不符合规定。可增加中间体(药液)、胶塞、铝盖、西林瓶、注射用水、纯化水质量标准。