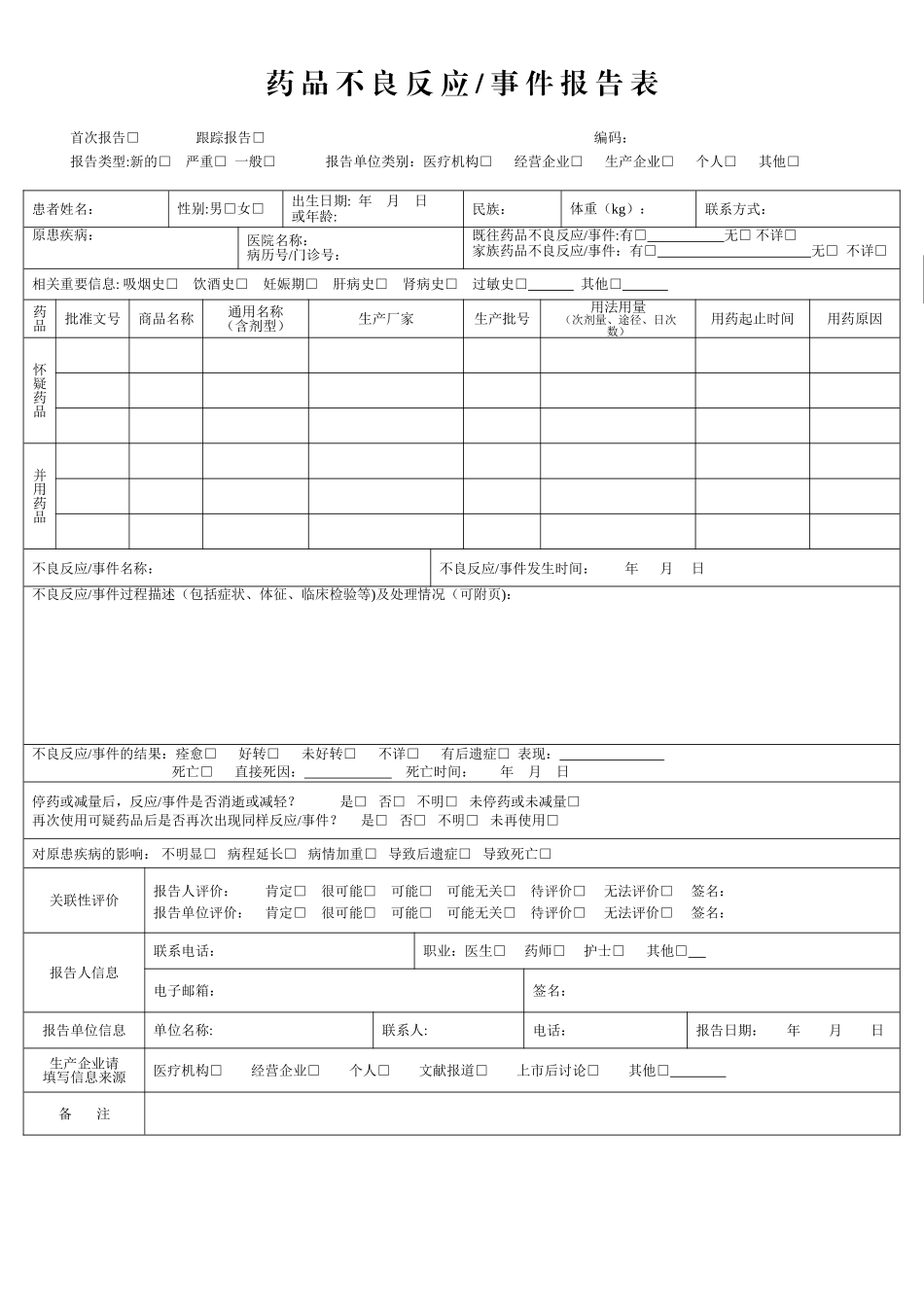
同公医药有限公司管理制度文件名称:药品不良反应报告管理制度编号:QM-020—001—2024修订部门:质管部修订人:批阅人:修订日期:批准日期:批准人:执行日期:版本号:2024 第一版一、概念1、药品不良反应(英文简称 ADR)是指合格药品在正常用法用量情况下出现的与用药目的无关或意外的有害反应。2、新的药品不良反应是指药品说明书中未载明的不良反应。3、药品严重不良反应是指因服用药品引起以下损害情形之一的反应;(1)引起死亡;(2)致癌、致畸、致出生缺陷;(3)对生命有危险并能够导致人体永久的或显著的伤残;(4)以器管功能产生永久损伤;(5)导致住院或住院时间延长。二、目的及依据为加强对公司所经营药品的安全监管,法律规范药品不良反应报告的管理,确保用药安全有效,根据《中华人民共和国药品管理法》、《药品不良反应报告和监测管理办法》(局令第 7 号),制定本制度。三、适应范围 本公司经营的所有品种产生不良反应的信息管理四、职责分配1、质管部是公司药品不良反应信息的综合处理部门,负责收集、分析、管理、上报药品的不良反应信息。2、销售部门是药品不良反应信息记录、跟踪、报告的责任部门。五、制度内容 1、药品不良反应实行逐级、定期报告制度,必要时可以越级报告. 2、业务部收集到所经营药品的不良反应信息,应当及时填报药品“药品不良反应/事件报告表”,上报质量管理部。 3、质管部应指定专(兼)职人员负责本公司经营药品的不良反应报告和监测工作,发现可能与用药有关的不良反应应详细记录、调查、分析、评价、处理,并填写“药品不良反应/事件报告表”,每季度集中向市药品不良反应监测中心报告,其中新的或严重的药品不良反应于发现之日起 15 日内报告,死亡病例须及时报告. 4、“药品不良反应/事件报告表”的填报内容应真实、完整、准确. 5、药品不良反应的报告范围: (1)新药监测期内的药品应报告该药品发生的所有不良反应;新药监测期已满的药品,报告该药品引起的严重的,新的不良反应。 (2)进口药品自首次获准进口之日起 5 年内,报告该进口药品发生的所有不良反应;满 5 年的,报告该进口药品发生的新的和严重的不良反应.此外,对进口药品发生的不良反应还应进行年度汇总报告,进口药品自首次获准进口之日 5 年内,每年汇总报告一次;满 5 年的,每 5 年汇总报告一次。代理经营的进口药品在其它国家和地区发生新的或严重的不良反应,公司应于不良反应发现之日起一个月内报告...