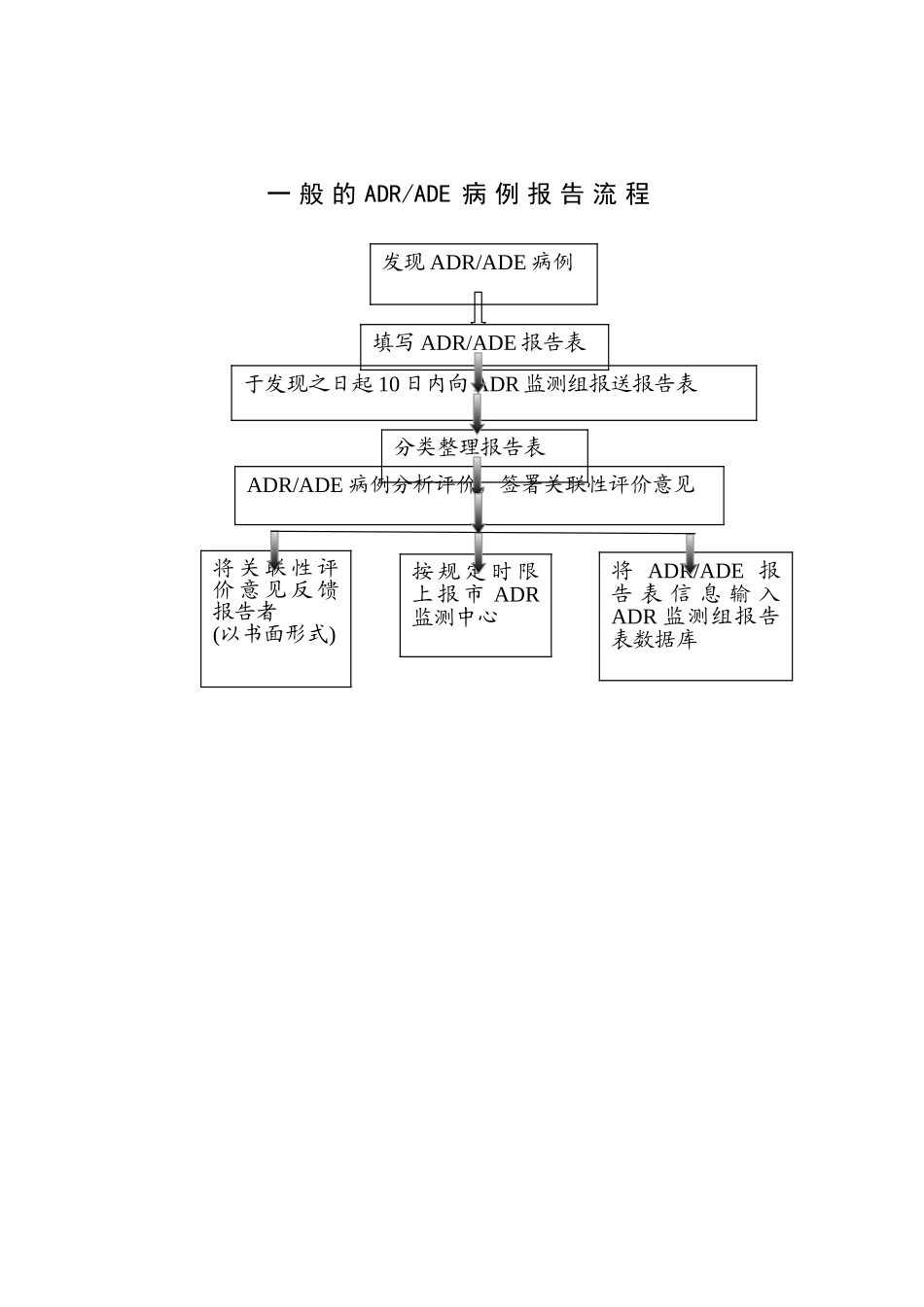
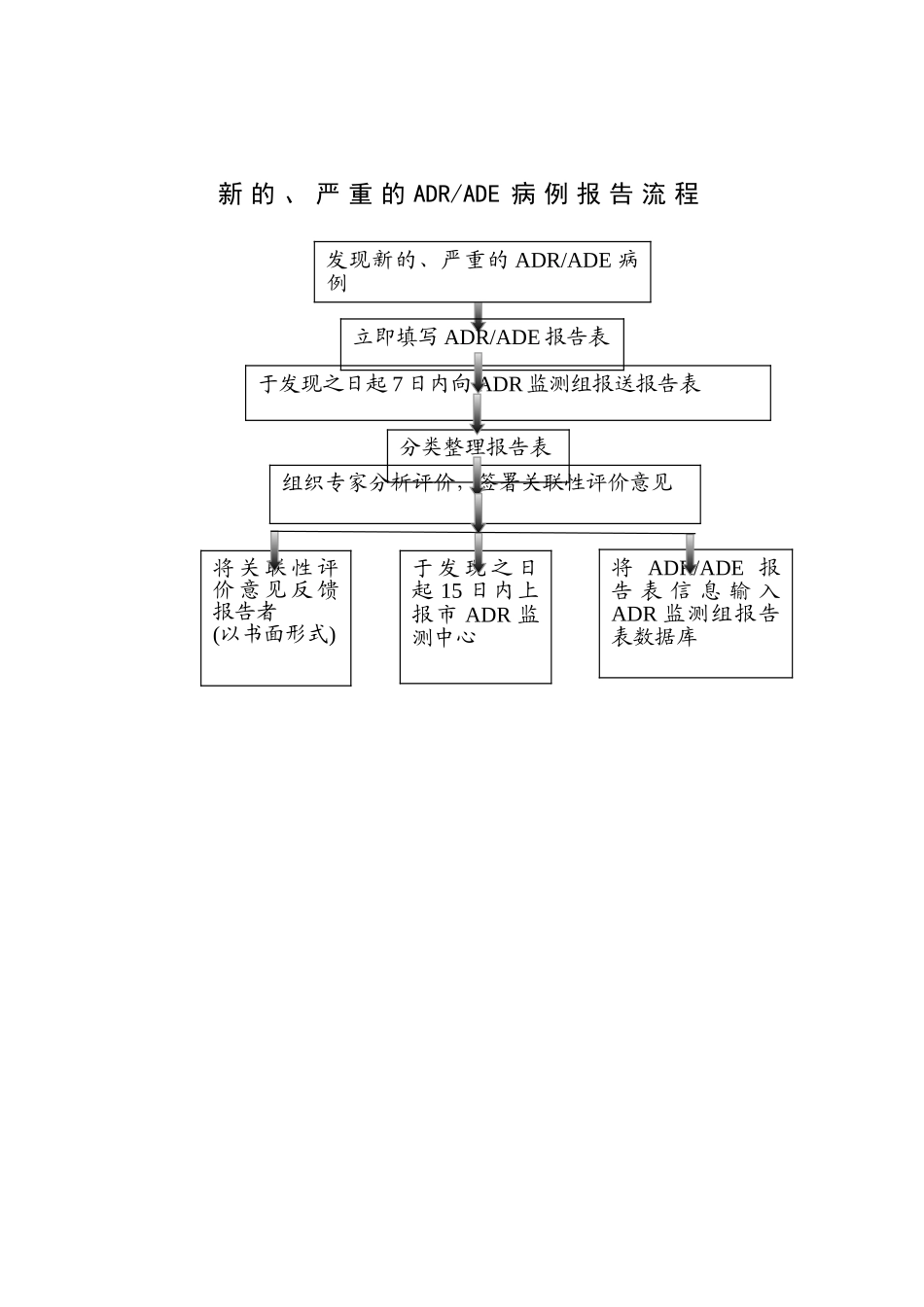
一 般 的 ADR/ADE 病 例 报 告 流 程发现 ADR/ADE 病例填写 ADR/ADE 报告表于发现之日起 10 日内向 ADR 监测组报送报告表分类整理报告表ADR/ADE 病例分析评价,签署关联性评价意见将 关 联 性 评价 意 见 反 馈报告者(以书面形式)按 规 定 时 限上 报 市 ADR监测中心将 ADR/ADE 报告 表 信 息 输 入ADR 监测组报告表数据库新 的 、 严 重 的 ADR/ADE 病 例 报 告 流 程发现新的、严重的 ADR/ADE 病例立即填写 ADR/ADE 报告表于发现之日起 7 日内向 ADR 监测组报送报告表分类整理报告表组织专家分析评价,签署关联性评价意见将 关 联 性 评价 意 见 反 馈报告者(以书面形式)于 发 现 之 日起 15 日内上报市 ADR 监测中心将 ADR/ADE 报告 表 信 息 输 入ADR 监测组报告表数据库死 亡 的 、 群 体 性 的 ADR/ADE 病 例 报 告 流 程立即报告 ADR 监测组、医务处立即组织核查及时填写报告表及时向 ADR 监测组报送报告表立即报告市 ADR监测中心和行政主管部门及时分类整理报告表及时填写报告表及时组织专家分析评价,签署关联性评价意见将 关 联 性 评价 意 见 反 馈报告者(以书面形式)及 时 报 告 市ADR 监 测 中心将 ADR/ADE 报告 表 信 息 输 入ADR 监测组报告表数据库发现死亡的、群体性的 ADR/ADE 病例