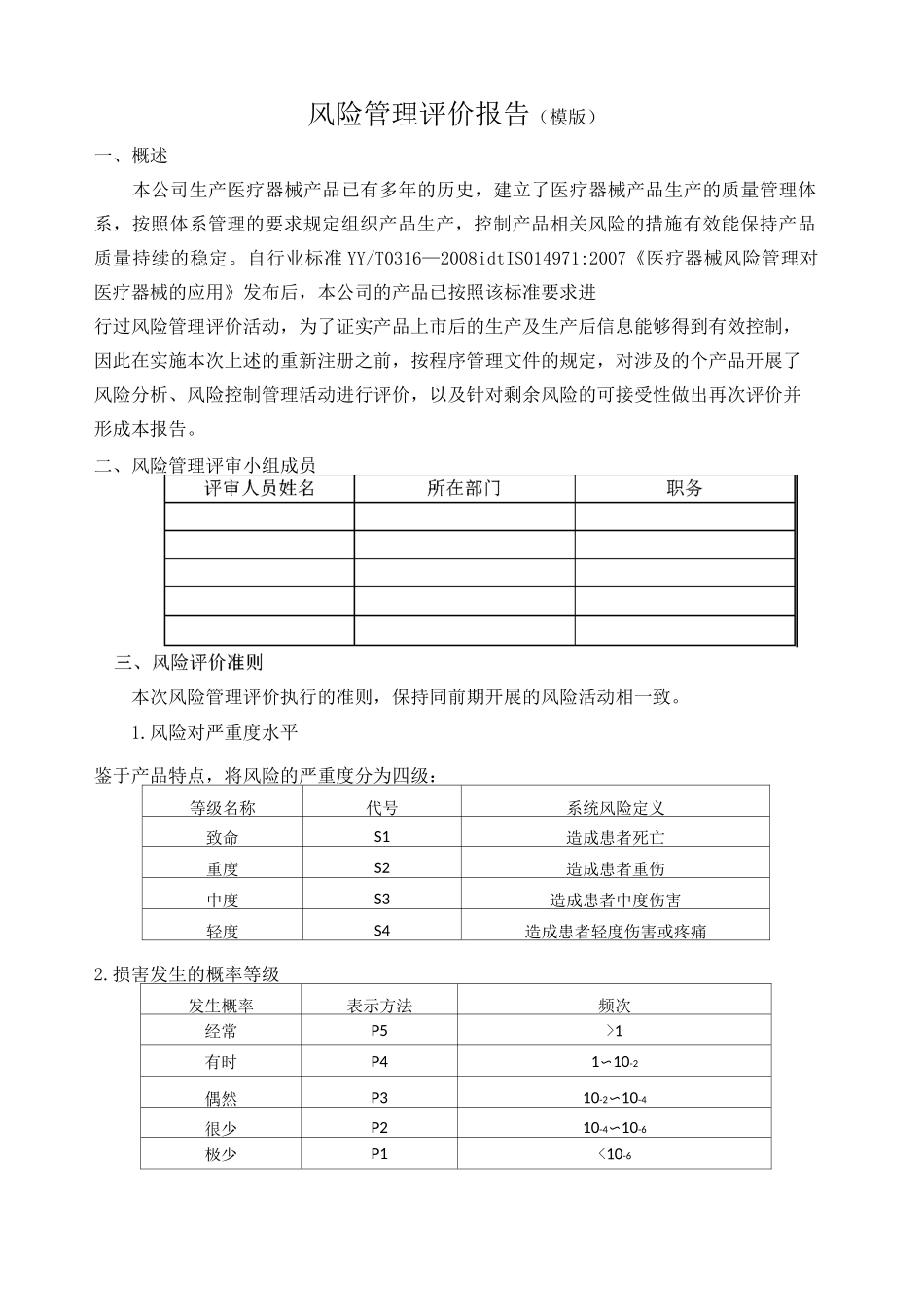
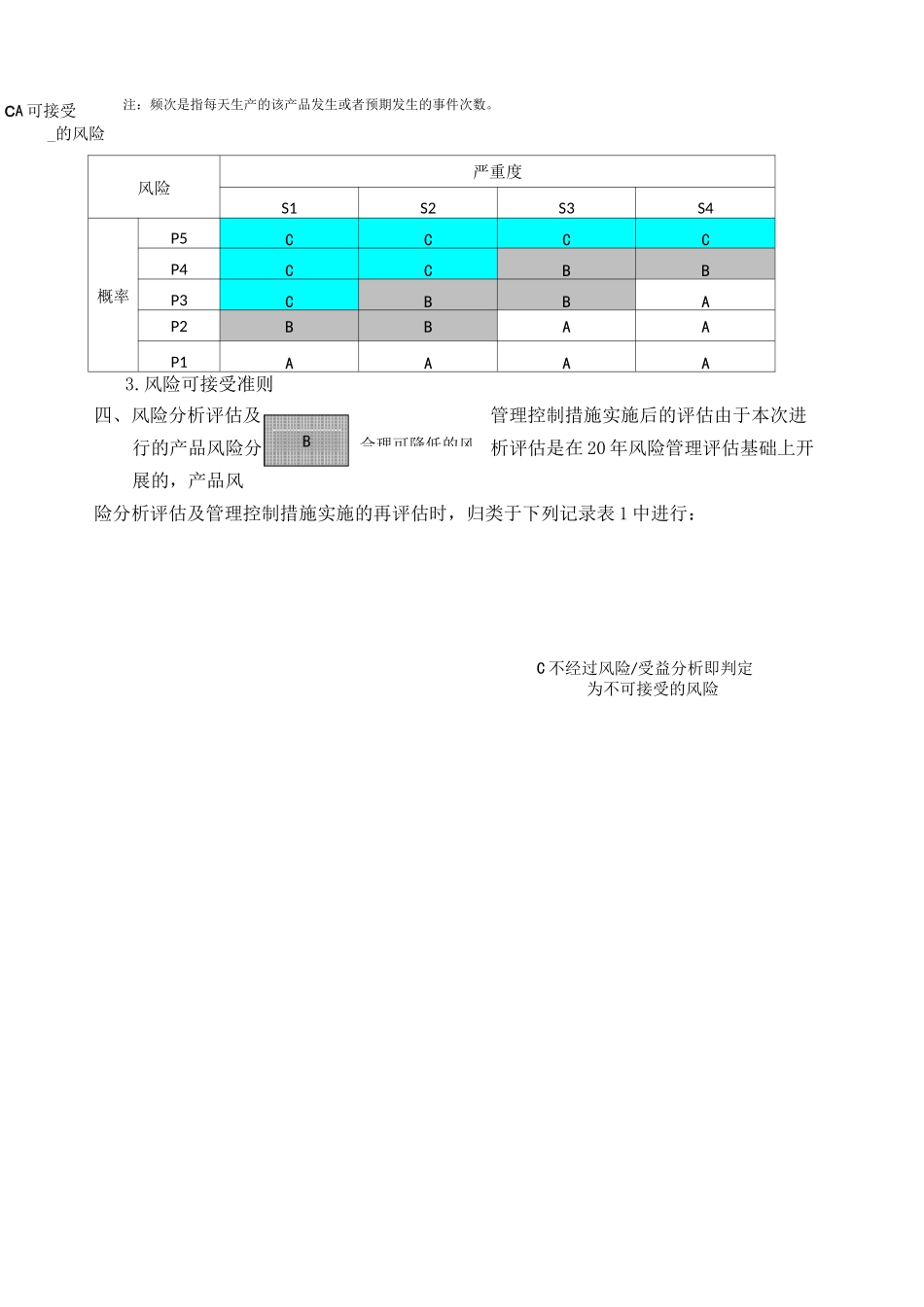
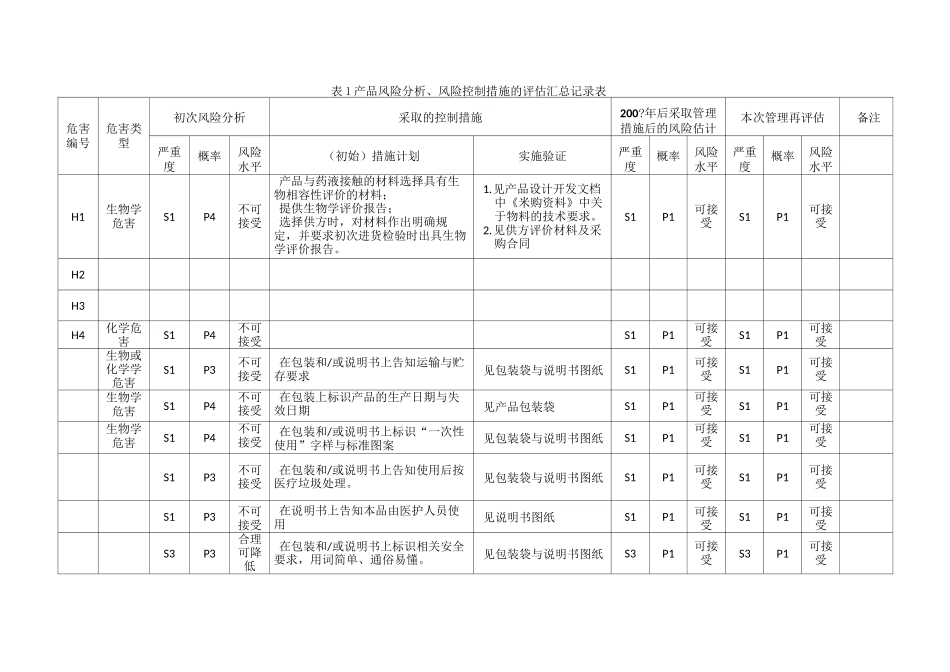
风险管理评价报告(模版)一、概述本公司生产医疗器械产品已有多年的历史,建立了医疗器械产品生产的质量管理体系,按照体系管理的要求规定组织产品生产,控制产品相关风险的措施有效能保持产品质量持续的稳定。自行业标准 YY/T0316—2008idtIS014971:2007《医疗器械风险管理对医疗器械的应用》发布后,本公司的产品已按照该标准要求进行过风险管理评价活动,为了证实产品上市后的生产及生产后信息能够得到有效控制,因此在实施本次上述的重新注册之前,按程序管理文件的规定,对涉及的个产品开展了风险分析、风险控制管理活动进行评价,以及针对剩余风险的可接受性做出再次评价并形成本报告。二、风险管理评审小组成员本次风险管理评价执行的准则,保持同前期开展的风险活动相一致。1.风险对严重度水平鉴于产品特点,将风险的严重度分为四级:等级名称代号系统风险定义致命S1造成患者死亡重度S2造成患者重伤中度S3造成患者中度伤害轻度S4造成患者轻度伤害或疼痛2.损害发生的概率等级发生概率表示方法频次经常P5>1有时P41〜10-2偶然P310-2〜10-4很少P210-4〜10-6极少P1<10-6CA 可接受_的风险注:频次是指每天生产的该产品发生或者预期发生的事件次数。风险严重度S1S2S3S4概率P5CCCCP4CCBBP3CBBAP2BBAAP1AAAA四、风险分析评估及管理控制措施实施后的评估由于本次进行的产品风险分析评估是在 20 年风险管理评估基础上开展的,产品风险分析评估及管理控制措施实施的再评估时,归类于下列记录表 1 中进行:合理可降低的风3.风险可接受准则C 不经过风险/受益分析即判定为不可接受的风险表 1 产品风险分析、风险控制措施的评估汇总记录表危害编号危害类型初次风险分析采取的控制措施200?年后采取管理措施后的风险估计本次管理再评估备注严重度概率风险水平(初始)措施计划实施验证严重度概率风险水平严重度概率风险水平H1生物学危害S1P4不可接受产品与药液接触的材料选择具有生物相容性评价的材料;提供生物学评价报告;选择供方时,对材料作出明确规定,并要求初次进货检验时出具生物学评价报告。1.见产品设计开发文档中《米购资料》中关于物料的技术要求。2.见供方评价材料及采购合同S1P1可接受S1P1可接受H2H3H4化学危害S1P4不可接受S1P1可接受S1P1可接受生物或化学学危害S1P3不可接受在包装和/或说明书上告知运输与贮存要求见包装袋与说明书图纸S1P1可接受S1P1可接受生物学危害S1P4不可接受在包装上标识产品的生产日期与失效日期见产品包装...