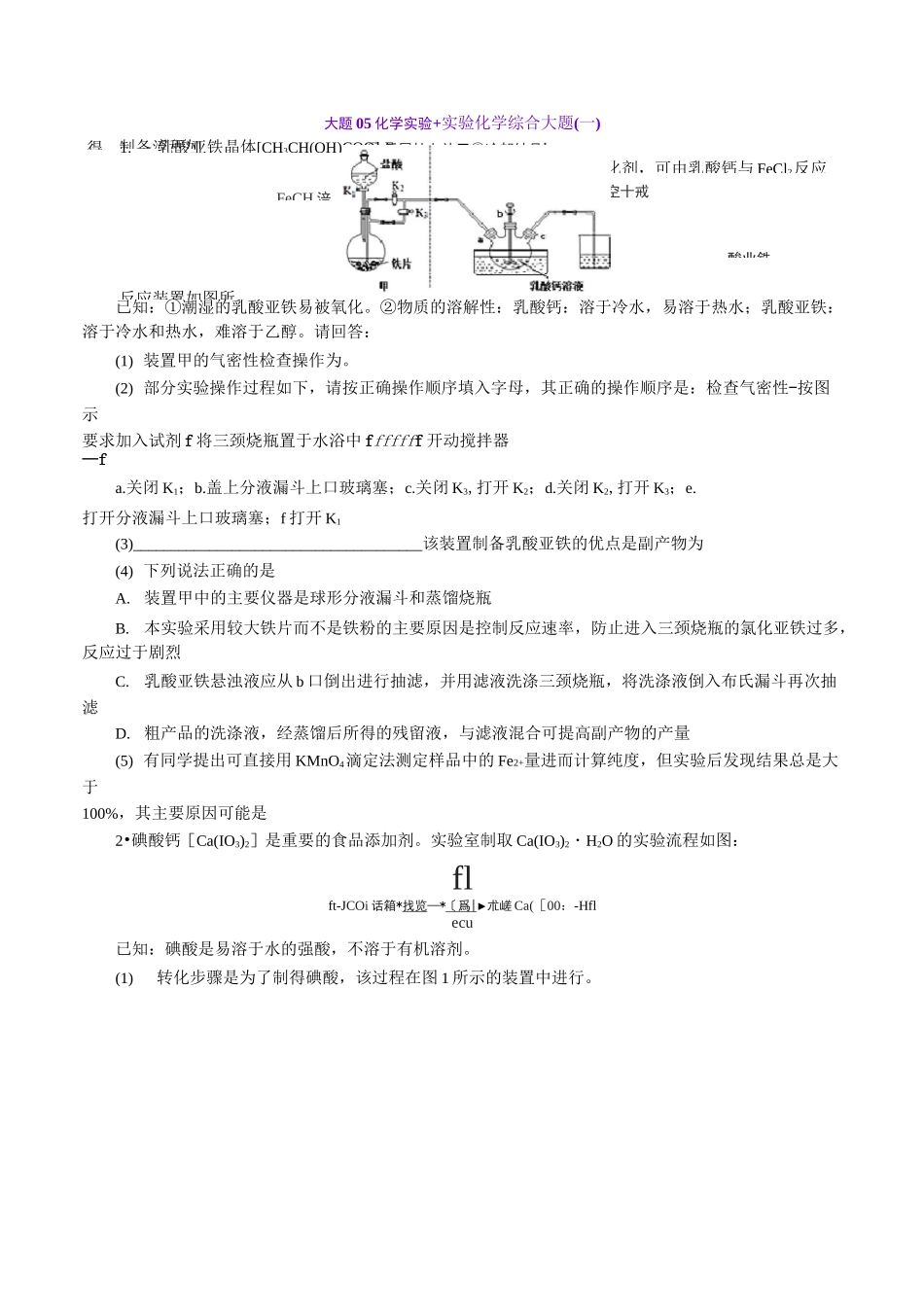
1.乳酸亚铁晶体[CH3CH(OH)COO]2Fe・种很好的食品铁强化剂,可由乳酸钙与 FeCl2反应得, 制备流程如FeCH 涪① 反尿技血讣 ▼②冷却结品’③ 过滤一曲占口〕邑二出 1洗济低温克空十戒酸业鉄反应装置如图所大题 05 化学实验+实验化学综合大题(一)已知:①潮湿的乳酸亚铁易被氧化。②物质的溶解性:乳酸钙:溶于冷水,易溶于热水;乳酸亚铁:溶于冷水和热水,难溶于乙醇。请回答:(1) 装置甲的气密性检查操作为。(2) 部分实验操作过程如下,请按正确操作顺序填入字母,其正确的操作顺序是:检查气密性-按图示要求加入试剂 f 将三颈烧瓶置于水浴中 fffffff 开动搅拌器—fa.关闭 K1;b.盖上分液漏斗上口玻璃塞;c.关闭 K3,打开 K2;d.关闭 K2,打开 K3;e.打开分液漏斗上口玻璃塞;f 打开 K1(3)______________________________________该装置制备乳酸亚铁的优点是副产物为(4) 下列说法正确的是A.装置甲中的主要仪器是球形分液漏斗和蒸馏烧瓶B.本实验采用较大铁片而不是铁粉的主要原因是控制反应速率,防止进入三颈烧瓶的氯化亚铁过多,反应过于剧烈C.乳酸亚铁悬浊液应从 b 口倒出进行抽滤,并用滤液洗涤三颈烧瓶,将洗涤液倒入布氏漏斗再次抽滤D.粗产品的洗涤液,经蒸馏后所得的残留液,与滤液混合可提高副产物的产量(5) 有同学提出可直接用 KMnO4滴定法测定样品中的 Fe2+量进而计算纯度,但实验后发现结果总是大于100%,其主要原因可能是2•碘酸钙[Ca(IO3)2]是重要的食品添加剂。实验室制取 Ca(IO3)2・H2O 的实验流程如图:flft-JCOi 话箱*找览—*〔爲 | ►朮嵯 Ca([00:-Hflecu已知:碘酸是易溶于水的强酸,不溶于有机溶剂。(1)转化步骤是为了制得碘酸,该过程在图 1 所示的装置中进行。A.B.C2Na2CO3・3H2O2(s)AHvO实验中采取的措施有冷水團 1① 当观察到现象时,停止通入氯气② 转化时发生反应的离子方程式为(2)___________________________________________________除去 HIO3水溶液中少量 I2单质的实验操作为直至用淀粉溶液检验不出碘单质的存在。已知:① Ca(IO3)2・6H2O 是一种难溶于水的白色固体,在碱性条件下不稳定。②Ca(IO3)2・6H2O 加热升温过程中固体的质量变化如图 2 所示(3)Ca(IO)3・6H20 在 100〜160°C 条件下加热得到的物质成分是(4)下列说法正确的是转化过程中 CCl4的作用只是增大 I2的溶解量,提高 I2的利用率为增大转化过程的反应速率,可适当加快通 Cl2的速度以除碘后的水...