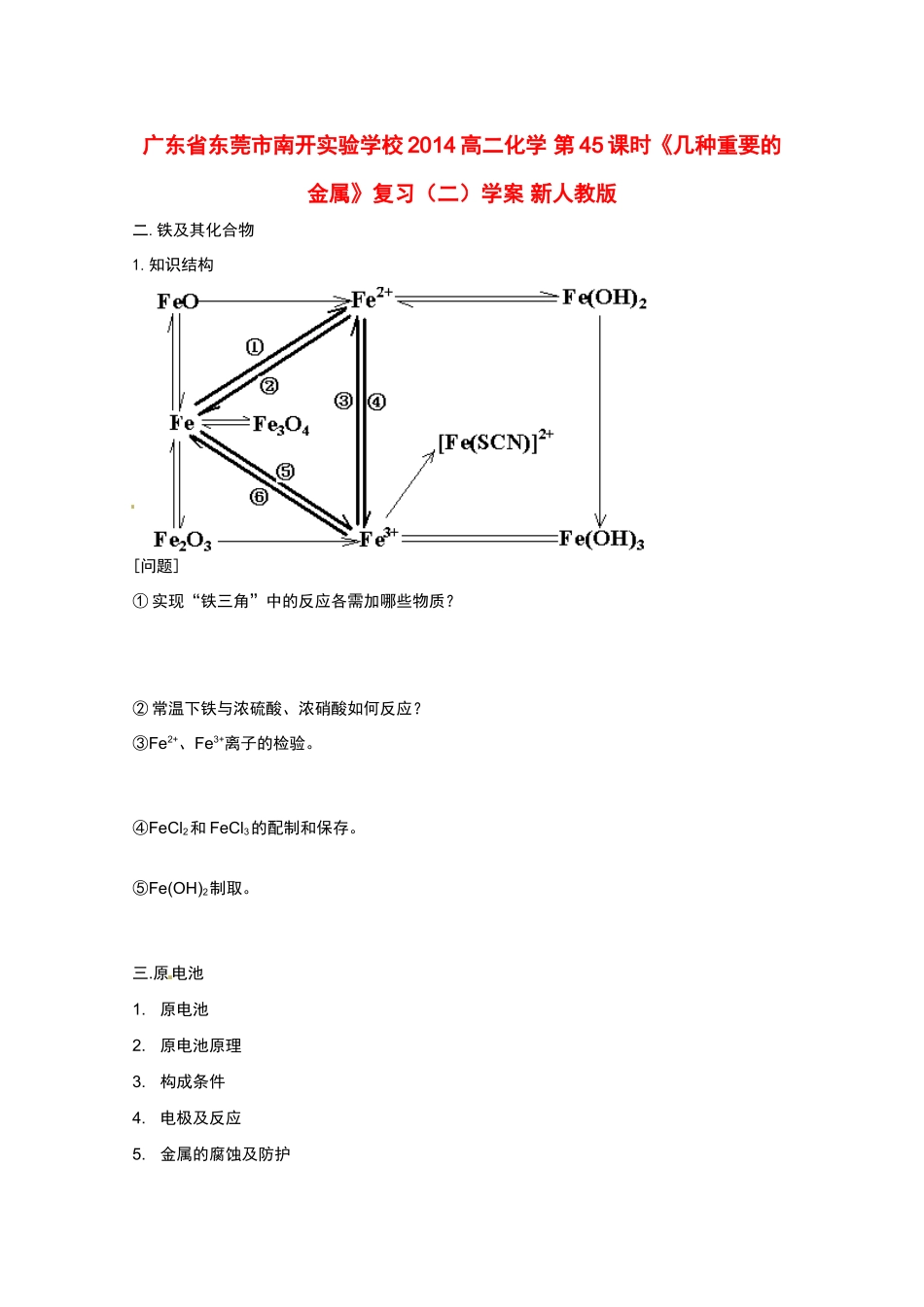
广东省东莞市南开实验学校 2014 高二化学 第 45 课时《几种重要的金属》复习(二)学案 新人教版二.铁及其化合物1.知识结构[问题]① 实现“铁三角”中的反应各需加哪些物质?② 常温下铁与浓硫酸、浓硝酸如何反应?③Fe2+、Fe3+离子的检验。④FeCl2和 FeCl3的配制和保存。⑤Fe(OH)2制取。三.原电池1.原电池2.原电池原理3.构成条件4.电极及反应5.金属的腐蚀及防护 知识要点金 属 腐蚀 实质金属的主要腐蚀种类原理区别 金 属 防 护[练习]1. 不 属 于 两 性 化 合 物 , 但 既 能 与 盐 酸 反 应 , 又 能 与 NaOH 溶 液 反 应 的 是 [ ]① Al②Fe③NaHCO3④NaHSO4⑤(NH4)2S⑥Fe2O3⑦Fe(OH)3A.①③⑤ B. ③④⑤ C. ③④⑥ D. ④⑤⑦2.在 CuCl2、FeCl3、AlCl3的混合溶液中加入铁片,若铁片剩余,则溶液中含有 离子;若铁片完全溶解,则溶液中肯定含有 离子;可能含有 离子,也可能含有上述两种离子中的 离子。3.用铝制饭盒盛放醋酸,一段时间后,饭盒被腐蚀,该种腐蚀属 ;若用铝饭盒盛放食盐,一段时间后,饭盒被腐蚀,这种腐蚀叫 ,反应原理是(写表达式) 4.将一生锈的铁片置于稀 HNO3中充分反应,共收集到 NO11.2L(STP),溶液中还剩余 5g固体残渣。过滤后,向滤液中通入 11.2L 氯气(STP),恰好使溶液中的亚铁离子全部氧化,计算原铁片和和铁锈的质量分数(铁锈的成分以 Fe2O3计)。