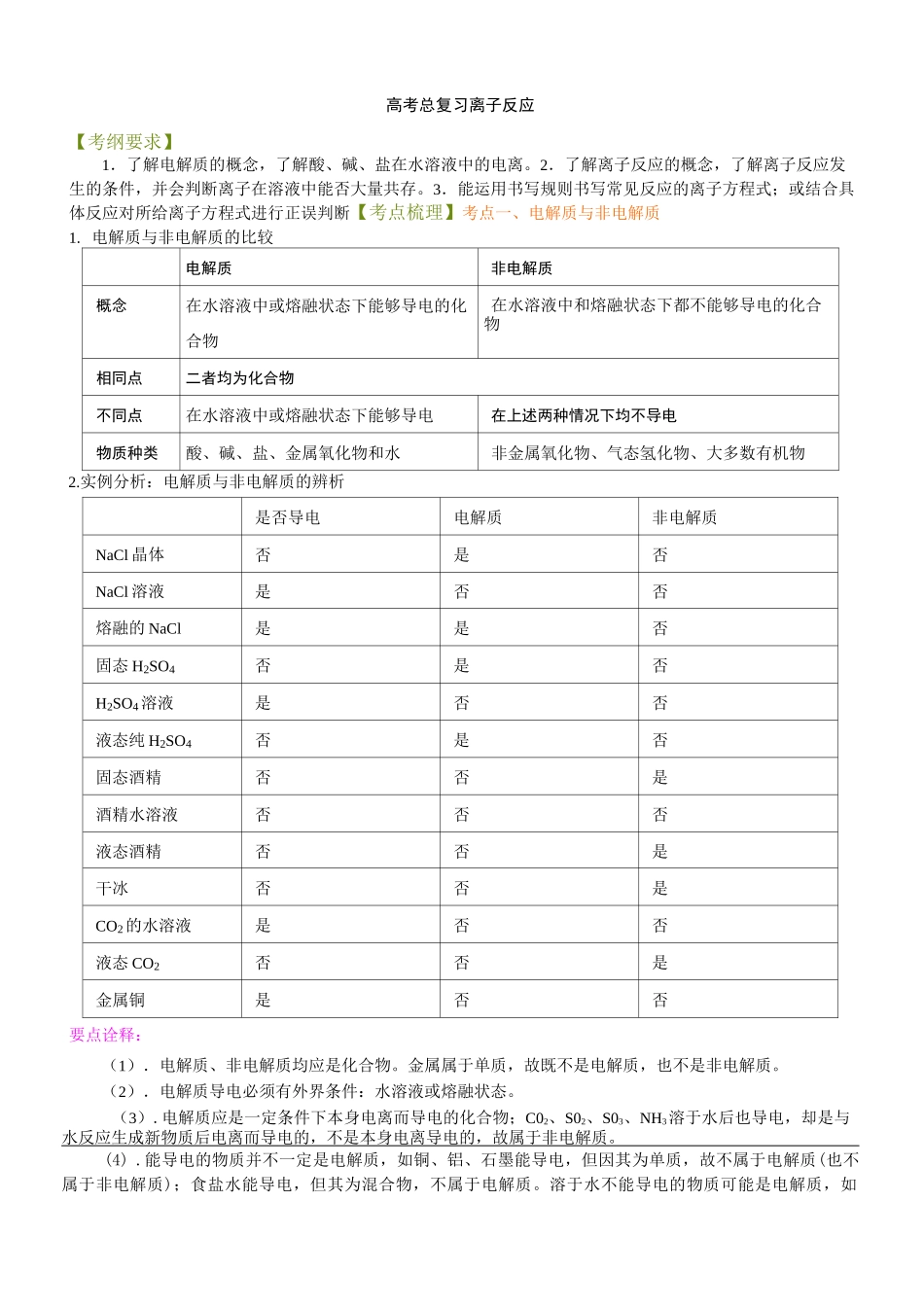
高考总复习离子反应【考纲要求】1.了解电解质的概念,了解酸、碱、盐在水溶液中的电离。2.了解离子反应的概念,了解离子反应发生的条件,并会判断离子在溶液中能否大量共存。3.能运用书写规则书写常见反应的离子方程式;或结合具体反应对所给离子方程式进行正误判断【考点梳理】考点一、电解质与非电解质1. 电解质与非电解质的比较电解质非电解质概念在水溶液中或熔融状态下能够导电的化合物在水溶液中和熔融状态下都不能够导电的化合物相同点二者均为化合物不同点在水溶液中或熔融状态下能够导电在上述两种情况下均不导电物质种类酸、碱、盐、金属氧化物和水非金属氧化物、气态氢化物、大多数有机物2.实例分析:电解质与非电解质的辨析是否导电电解质非电解质NaCl 晶体否是否NaCl 溶液是否否熔融的 NaCl是是否固态 H2SO4否是否H2SO4溶液是否否液态纯 H2SO4否是否固态酒精否否是酒精水溶液否否否液态酒精否否是干冰否否是CO2的水溶液是否否液态 CO2否否是金属铜是否否要点诠释:(1).电解质、非电解质均应是化合物。金属属于单质,故既不是电解质,也不是非电解质。(2).电解质导电必须有外界条件:水溶液或熔融状态。(3).电解质应是一定条件下本身电离而导电的化合物;C02、S02、S03、NH3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。(4) .能导电的物质并不一定是电解质,如铜、铝、石墨能导电,但因其为单质,故不属于电解质(也不属于非电解质);食盐水能导电,但其为混合物,不属于电解质。溶于水不能导电的物质可能是电解质,如BaSO4难溶于水,但其溶于水的部分是完全电离的,属于电解质。考点二、强电解质与弱电解质1、强电解质与弱电解质的比较强电解质弱电解质概念水溶液中全部电离的电解质水溶液中部分电离的电解质相同点都是电解质,在水溶液中或熔融状态下都能电离,都能导电,与溶解度无关不同占八、、电离程度完全电离部分电离电离过程不可逆过程可逆过程,存在电离平衡表示方法电离方程式用“==”电离方程式用“-”溶液中溶质微粒只有水合离子水合离子,弱电解质分子实例强酸:HCl、HNO3、H2SO4HBr、HI、HCIO4等强碱:KOH、NaOH、Ba(OH)2Ca(OH)2绝大多数盐:BaSO4、AgCl、CaCO3弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3、H2SiO3、CH3COOH、等。弱碱:NH3・H2O、Al(OH)3等不溶性碱,H2O要点诠释:电解质的强弱是以电离的程度来区分的,与物质的溶解度、溶液的导电能...