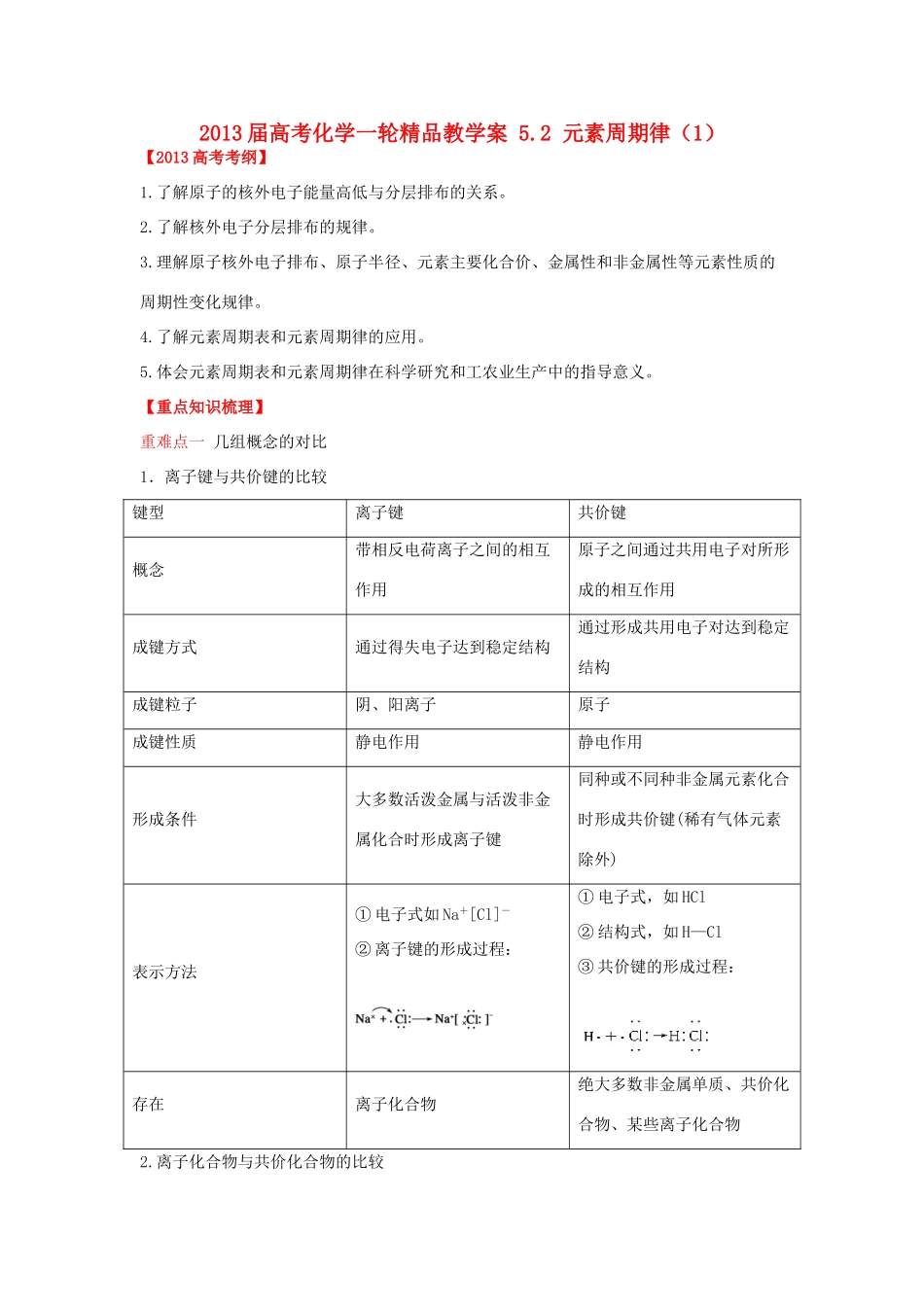
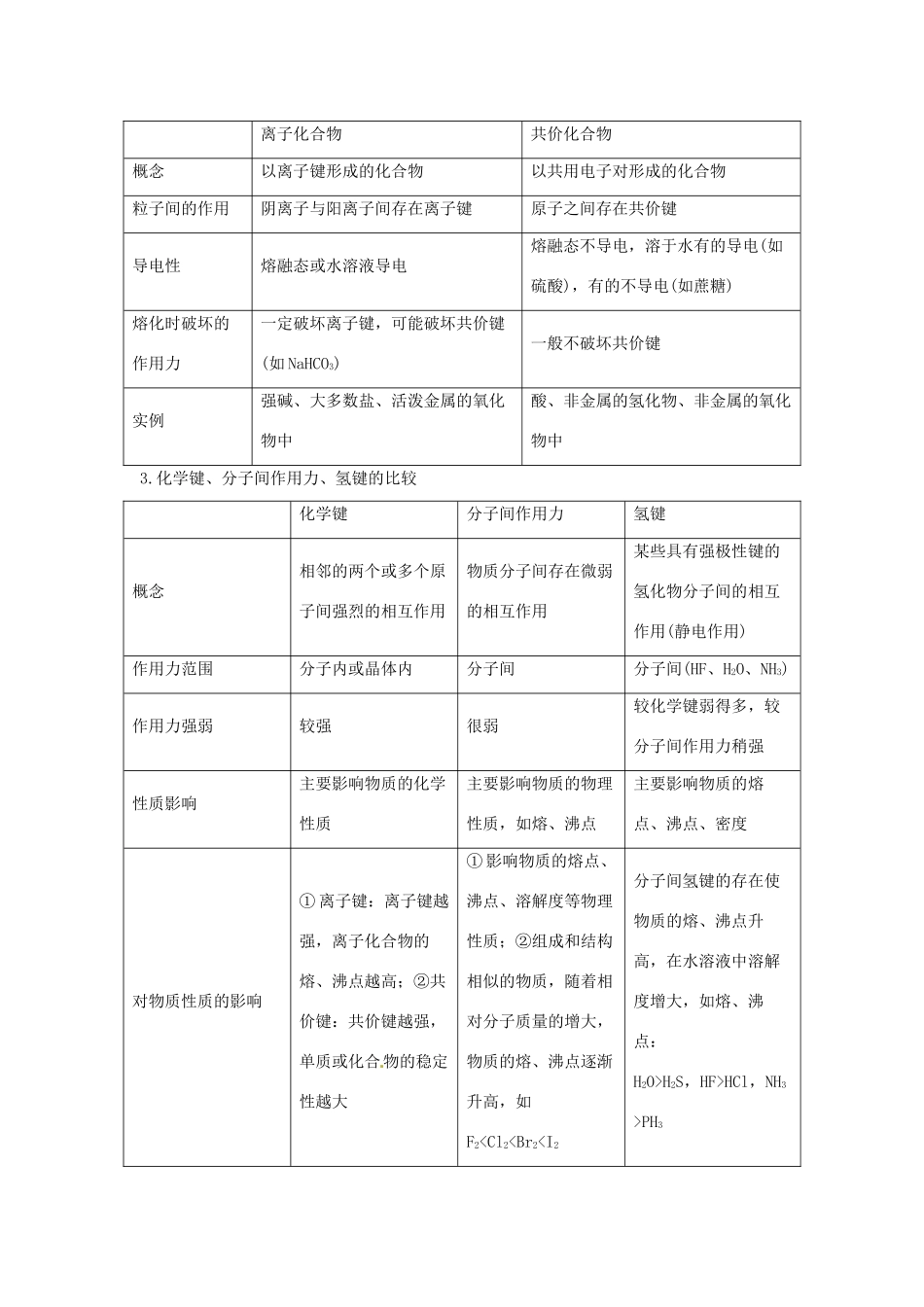
2013 届高考化学一轮精品教学案 5.2 元素周期律(1)【2013 高考考纲】1.了解原子的核外电子能量高低与分层排布的关系。2.了解核外电子分层排布的规律。3.理解原子核外电子排布、原子半径、元素主要化合价、金属性和非金属性等元素性质的周期性变化规律。4.了解元素周期表和元素周期律的应用。5.体会元素周期表和元素周期律在科学研究和工农业生产中的指导意义。【重点知识梳理】重难点一 几组概念的对比1.离子键与共价键的比较键型离子键共价键概念带相反电荷离子之间的相互作用原子之间通过共用电子对所形成的相互作用成键方式通过得失电子达到稳定结构通过形成共用电子对达到稳定结构成键粒子阴、阳离子原子成键性质静电作用静电作用形成条件大多数活泼金属与活泼非金属化合时形成离子键同种或不同种非金属元素化合时形成共价键(稀有气体元素除外)表示方法① 电子式如 Na+[Cl]-② 离子键的形成过程:① 电子式,如 HCl② 结构式,如 H—Cl③ 共价键的形成过程:存在离子化合物绝大多数非金属单质、共价化合物、某些离子化合物2.离子化合物与共价化合物的比较离子化合物共价化合物概念以离子键形成的化合物以共用电子对形成的化合物粒子间的作用阴离子与阳离子间存在离子键原子之间存在共价键导电性熔融态或水溶液导电熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)熔化时破坏的作用力一定破坏离子键,可能破坏共价键(如 NaHCO3)一般不破坏共价键实例强碱、大多数盐、活泼金属的氧化物中酸、非金属的氢化物、非金属的氧化物中3.化学键、分子间作用力、氢键的比较化学键分子间作用力氢键概念相邻的两个或多个原子间强烈的相互作用物质分子间存在微弱的相互作用某些具有强极性键的氢化物分子间的相互作用(静电作用)作用力范围分子内或晶体内分子间分子间(HF、H2O、NH3)作用力强弱较强很弱较化学键弱得多,较分子间作用力稍强性质影响主要影响物质的化学性质主要影响物质的物理性质,如熔、沸点主要影响物质的熔点、沸点、密度对物质性质的影响① 离子键:离子键越强,离子化合物的熔、沸点越高;②共价键:共价键越强,单质或化合物的稳定性越大① 影响物质的熔点、沸点、溶解度等物理性质;②组成和结构相似的物质,随着相对分子质量的增大,物质的熔、沸点逐渐升高,如F2H2S,HF>HCl,NH3>PH3重难点二 物质中化学键的...