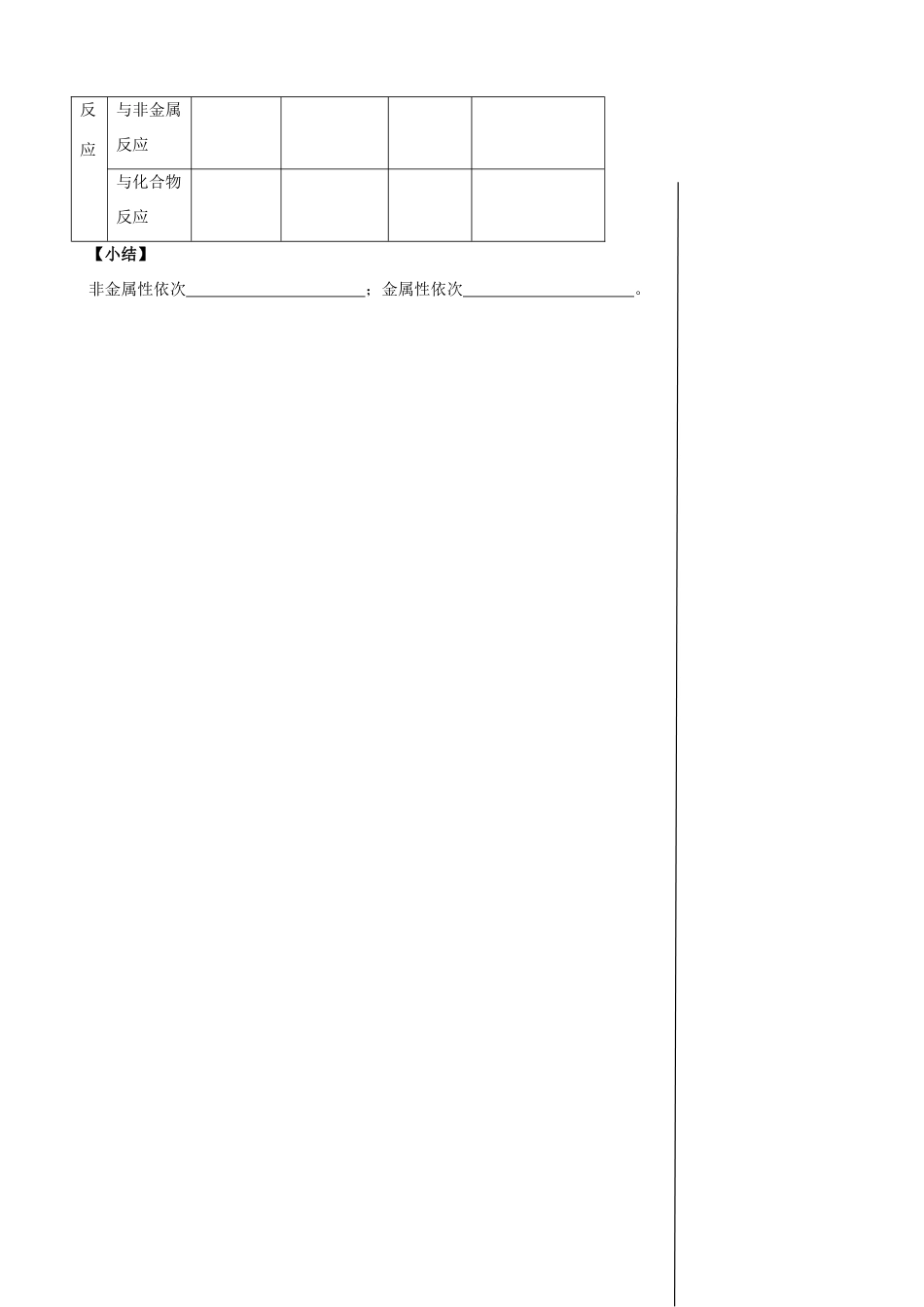
第一课时 氧族元素 【考纲要求】 1.理解氧族元素的性质递变规律; 2. 以硫元素为代表,了解氧族元素的单质、氢化物及其氧化物的重要性质; 3. 了解硫的氧化物对环境的污染及环境保护的意义 教与学方案 笔记与反思 【自学反馈】1.氧族元素的原子结构及性质递变规律元素名称和符号氧(O)硫(S)硒(Se)碲(Te)原子结构原子序数结构示意图电子式主要化合价相同点不同点原子半径物理颜色和状态密度性质熔、沸点水、有机溶剂溶解度化学与金属反应反应与非金属反应与化合物反应【小结】非金属性依次 ;金属性依次 。22.硫的氢化物氧化物及其水化物的结构、性质3.金属硫化物的颜色和溶解性4.硫单质与氢化物、氧化物的性质及化合价关系强还原性 氧化性、还原性 强氧化性特别注意:中间价态的两类硫既有氧化性,又有还原性,SO2、H2SO3、Na2SO3以还类别氢化物氧化物氧化物水化物结构分子式H2SSO2SO3H2SO3H2SO4化学键晶体类型物理性质色、味、态毒性化学性质溶解性与金属反应不反应不反应稳定性不稳定稳定较稳定不稳定稳定水溶液的酸性强弱弱酸性 检 验使含 Pb2+的湿润 试 纸 变 黑或与 Cu2+反应生 成 CuS 沉淀原性为主。5. 硫的四种价态间的含硫物质之间的网络关系 ①H2S 是具有臭蛋气味的剧毒气体,其水溶液——氢硫酸是一种具有挥发性的二元弱酸,硫化氢、氢硫酸都具有强还原性可被碘水、溴水、氯水、FeCl3溶液、HNO3等氧化。H2S 能燃烧,燃烧依反应条件不同而不同。② 硫 与 Fe 、 Cu 反 应 时 , 由 于 其 非 金 属 性 比 氯 弱 , 所 以 生 成 低 价 态 的 物 质FeS、Cu2S。③ 硫的氧化物有 SO2和 SO3,其中 SO2是一种有刺激气味的气体,易液化,易溶于水——其水溶液叫亚硫酸、二元弱酸。SO2是重要的大气污染物(其危害详见课本),防治方法有排烟除硫燃料脱硫等。6.臭氧的性质:(1)物理性质:在常温常压下,臭氧是一种有 的 色 体,密度比氧气 , 溶于水;液态臭氧呈 色,固态臭氧呈 色。(2)化学性质:① 极强的氧化性:O 3 +KI + H2O = ② 不稳定性: ③ 漂白性:漂白原理是依靠 性,因此臭氧是一种很好的 剂和 剂;④ 产生方式: (用化学方程式表示)7.过氧化氢的性质:过氧化氢中氧元素的化合价是 价,因此过氧化氢表现为即有 性又有 性,并以 性为主,过氧化氢的水溶液俗称 呈弱酸性。a.化学性质:(1)当遇到强还原剂时,体现氧化性,如...