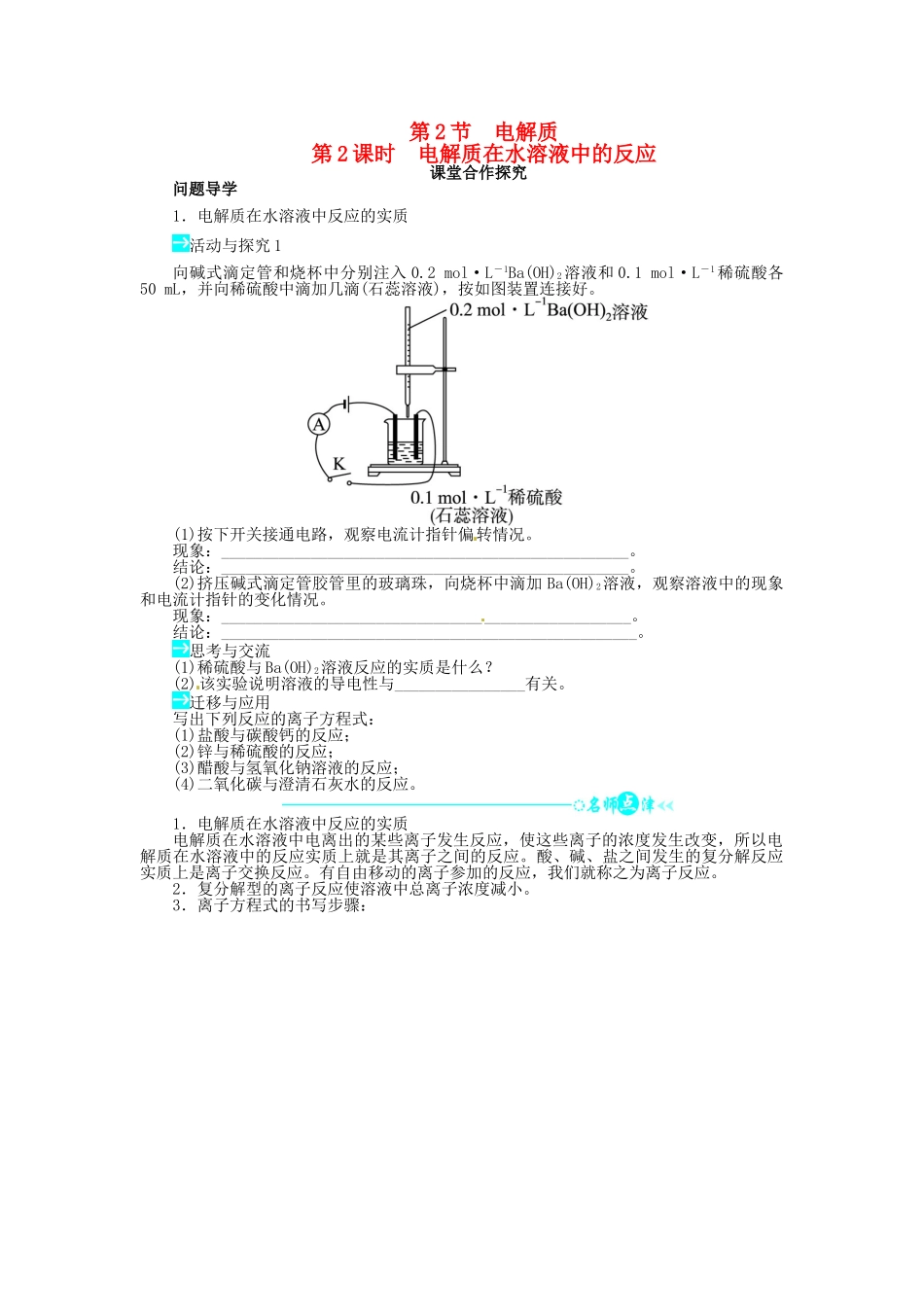
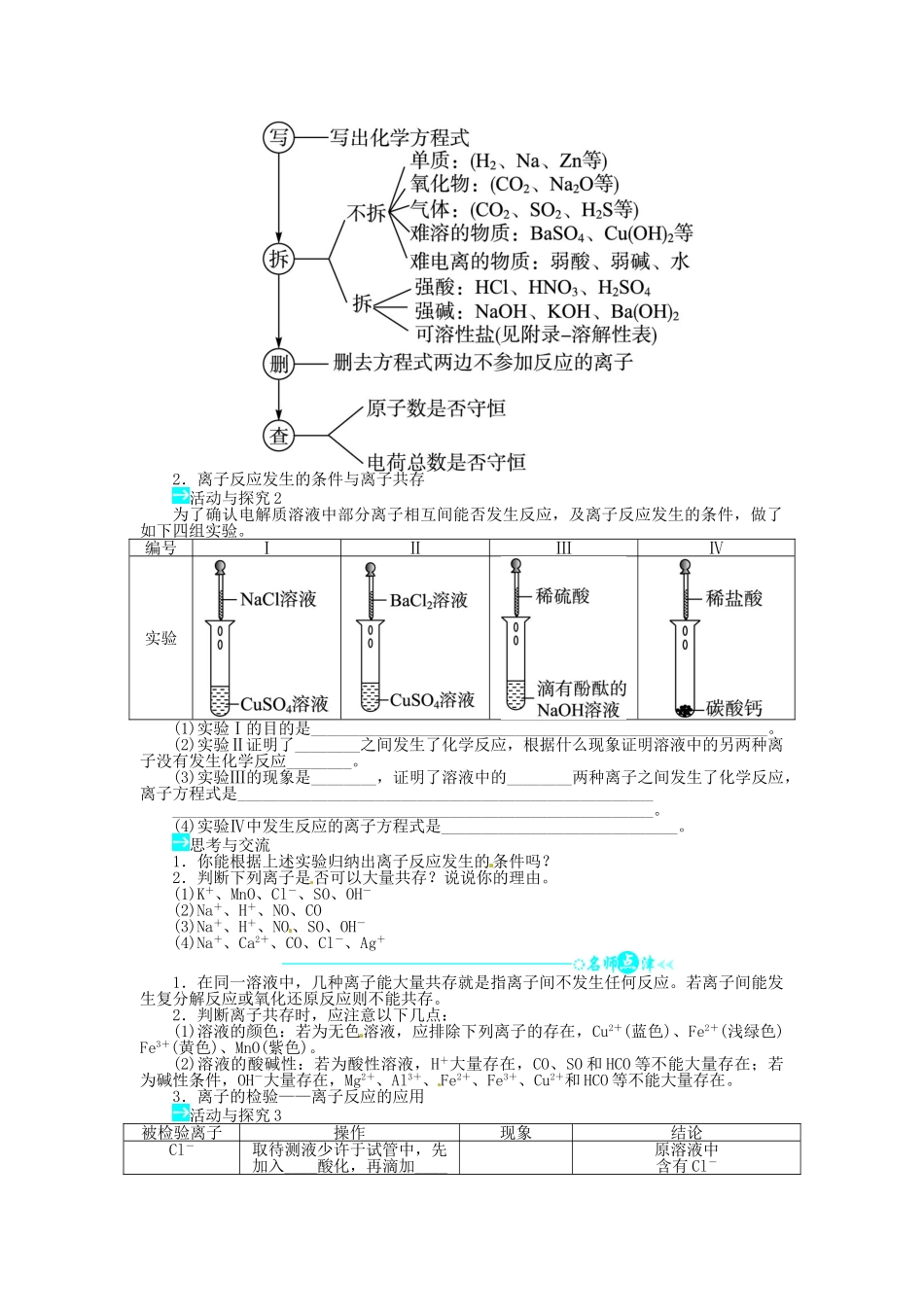
第 2 节 电解质第 2 课时 电解质在水溶液中的反应课堂合作探究问题导学1.电解质在水溶液中反应的实质活动与探究 1向碱式滴定管和烧杯中分别注入 0.2 mol·L-1Ba(OH)2溶液和 0.1 mol·L-1稀硫酸各50 mL,并向稀硫酸中滴加几滴(石蕊溶液),按如图装置连接好。(1)按下开关接通电路,观察电流计指针偏转情况。现象:__________________________________________________。结论:__________________________________________________。(2)挤压碱式滴定管胶管里的玻璃珠,向烧杯中滴加 Ba(OH)2溶液,观察溶液中的现象和电流计指针的变化情况。现象:__________________________________________________。结论:___________________________________________________。思考与交流(1)稀硫酸与 Ba(OH)2溶液反应的实质是什么?(2)该实验说明溶液的导电性与________________有关。迁移与应用写出下列反应的离子方程式:(1)盐酸与碳酸钙的反应;(2)锌与稀硫酸的反应;(3)醋酸与氢氧化钠溶液的反应;(4)二氧化碳与澄清石灰水的反应。1.电解质在水溶液中反应的实质电解质在水溶液中电离出的某些离子发生反应,使这些离子的浓度发生改变,所以电解质在水溶液中的反应实质上就是其离子之间的反应。酸、碱、盐之间发生的复分解反应实质上是离子交换反应。有自由移动的离子参加的反应,我们就称之为离子反应。2.复分解型的离子反应使溶液中总离子浓度减小。3.离子方程式的书写步骤:2.离子反应发生的条件与离子共存活动与探究 2为了确认电解质溶液中部分离子相互间能否发生反应,及离子反应发生的条件,做了如下四组实验。编号ⅠⅡⅢⅣ实验(1)实验Ⅰ的目的是________________________________________________________。(2)实验Ⅱ证明了________之间发生了化学反应,根据什么现象证明溶液中的另两种离子没有发生化学反应________。(3)实验Ⅲ的现象是________,证明了溶液中的________两种离子之间发生了化学反应,离子方程式是______________________________________________________________________________________________________________。(4)实验Ⅳ中发生反应的离子方程式是_____________________________。思考与交流1.你能根据上述实验归纳出离子反应发生的条件吗?2.判断下列离子是否可以大量共存?说说你的理由。(1)K+、MnO、Cl-、SO、OH-(2)Na+、H+、NO、CO(3)Na+、H+、NO、SO、OH-(4)Na+、Ca2+、CO、Cl-、Ag+1....