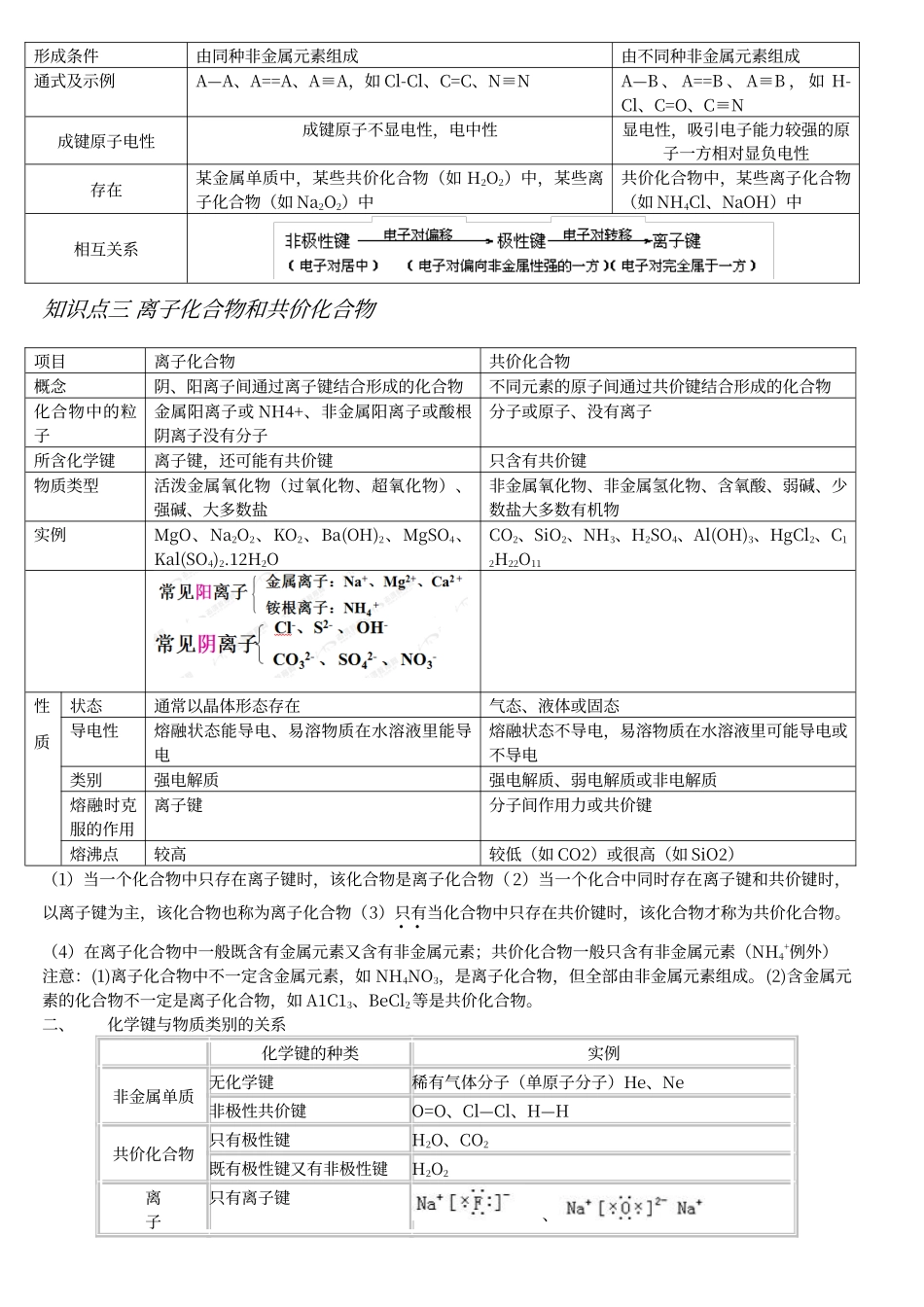
高中化学必修 2 知识点归纳总结第一章 物质结构 元素周期律第三节 化学键知识点一化学键的定义一、化学键:使离子相结合或使原子相结合的作用力叫做化学键。相邻的(两个或多个)离子或原子间的强烈的相互作用。【对定义的强调】(1)首先必须相邻。不相邻一般就不强烈 (2)只相邻但不强烈,也不叫化学键 (3)“相互作用”不能说成“相互吸引”(实际既包括吸引又包括排斥)一定要注意“相邻”和“强烈”。如水分子里氢原子和氧原子之间存在化学键,而两个氢原子之间及水分子与水分子之间是不存在化学键的。二、形成原因:原子有达到稳定结构的趋势,是原子体系能量降低。三、类型: 离子键 化学键 共价键 极性键 非极性键知识点二离子键和共价键一、离子键和共价键比较化学键类型离子键共价键概念阴、阳离子间通过静电作用所形成的化学键原子间通过共用电子对所形成的化学键成键微粒阴、阳离子原子成键性质静电作用共用电子对形成条件活泼金属与活泼非金属a.IA、Ⅱ A 族的金属元素与Ⅵ A、Ⅶ A 族的非金属元素。 b.金属阳离子与某些带电的原子团之间(如Na+与0H—、SO42-等)。非金属元素的原子之间某些不活泼金属与非金属之间。形成示例 共用电子对存在离子化合物中非金属单质、共价化合物和部分离子化合物中作用力大小一般阴、阳离子电荷数越多离子半径越小作用力越强原子半径越小,作用力越强与性质的关系离子间越强离子化合物的熔沸点越高。如:MgO>NaCl共价键越强(键能越大),所形成的共价分子越稳定,所形成的原子晶体的熔沸点越高。如稳定性:H2O>H2S,熔沸点:金刚石>晶体硅实例NaCl、MgOCl2、HCl、NaOH(O、H之间)二、非极性键和极性键 非极性共价键极性共价键概念同种元素原子形成的共价键不同种元素原子形成的共价键,共用电子对发生偏移原子吸引电子能力相同不同共用电子对不偏向任何一方偏向吸引电子能力强的原子形成条件由同种非金属元素组成由不同种非金属元素组成通式及示例A—A、A==A、A≡A,如 Cl-Cl、C=C、N≡NA—B 、 A==B 、 A≡B , 如 H-Cl、C=O、C≡N成键原子电性成键原子不显电性,电中性显电性,吸引电子能力较强的原子一方相对显负电性存在某金属单质中,某些共价化合物(如 H2O2)中,某些离子化合物(如 Na2O2)中共价化合物中,某些离子化合物(如 NH4Cl、NaOH)中相互关系知识点三 离子化合物和共价化合物项目离子化合物共价化合物概念阴、阳离子间通过离子键结合形成的化合物...