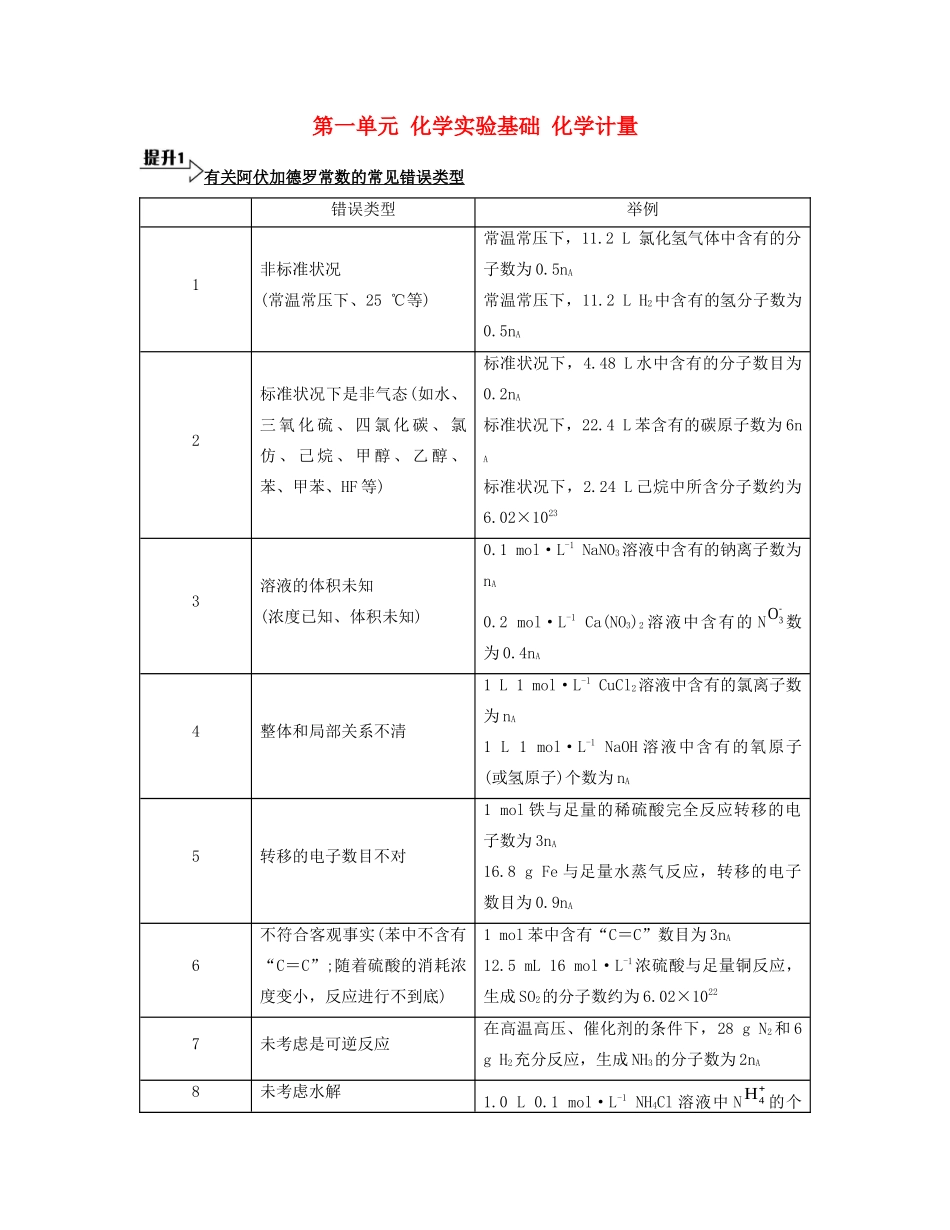
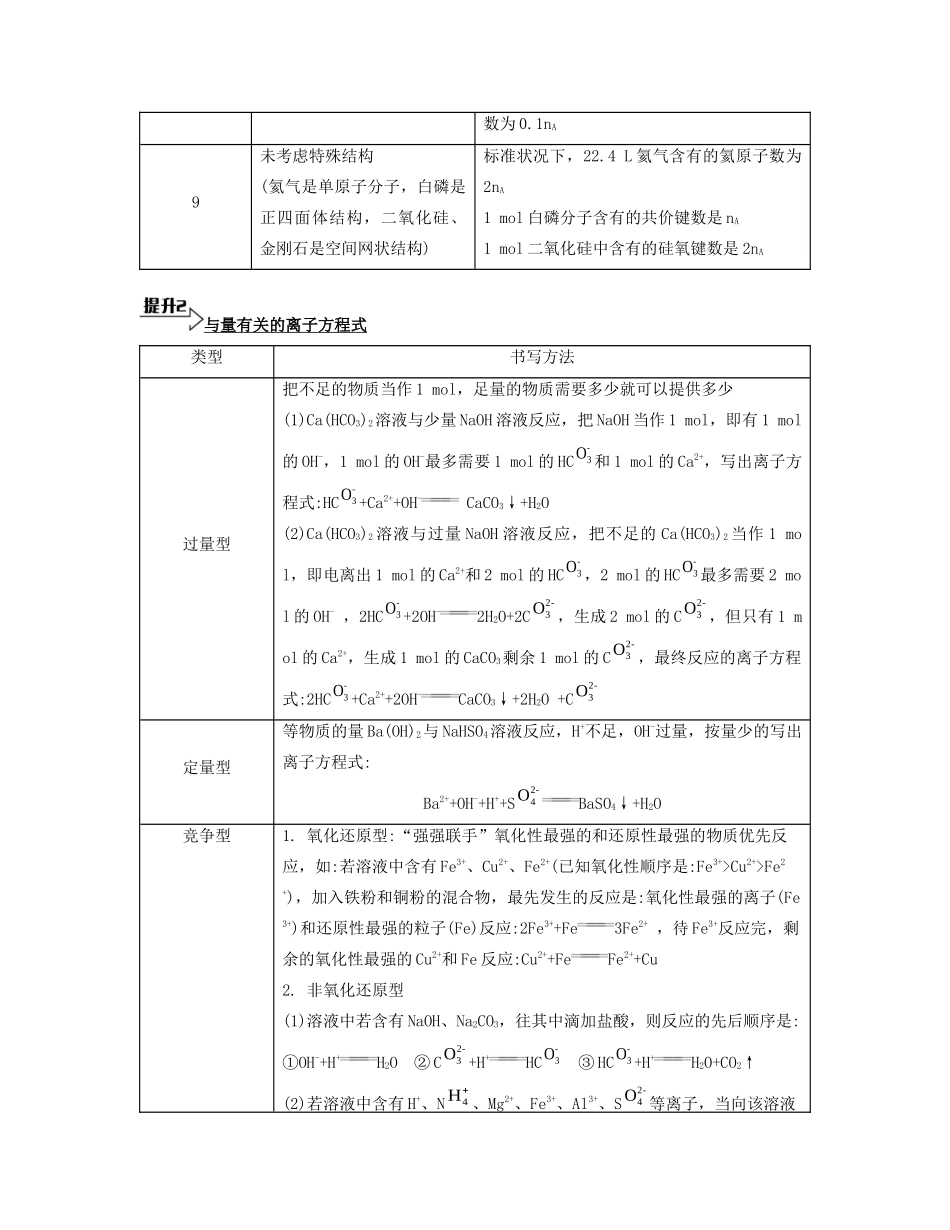
第一单元 化学实验基础 化学计量有关阿伏加德罗常数的常见错误类型错误类型举例1非标准状况(常温常压下、25 ℃等)常温常压下,11.2 L 氯化氢气体中含有的分子数为 0.5nA常温常压下,11.2 L H2中含有的氢分子数为0.5nA2标准状况下是非气态(如水、三 氧 化 硫 、 四 氯 化 碳 、 氯仿 、 己 烷 、 甲 醇 、 乙 醇 、苯、甲苯、HF 等)标准状况下,4.48 L 水中含有的分子数目为0.2nA标准状况下,22.4 L 苯含有的碳原子数为 6nA标准状况下,2.24 L 己烷中所含分子数约为6.02×10233溶液的体积未知(浓度已知、体积未知)0.1 mol·L-1 NaNO3溶液中含有的钠离子数为nA0.2 mol·L-1 Ca(NO3)2 溶液中含有的 N数为 0.4nA4整体和局部关系不清1 L 1 mol·L-1 CuCl2溶液中含有的氯离子数为 nA1 L 1 mol·L-1 NaOH 溶液中含有的氧原子(或氢原子)个数为 nA5转移的电子数目不对1 mol 铁与足量的稀硫酸完全反应转移的电子数为 3nA16.8 g Fe 与足量水蒸气反应,转移的电子数目为 0.9nA6不符合客观事实(苯中不含有“C=C”;随着硫酸的消耗浓度变小,反应进行不到底)1 mol 苯中含有“C=C”数目为 3nA12.5 mL 16 mol·L-1浓硫酸与足量铜反应,生成 SO2的分子数约为 6.02×10227未考虑是可逆反应在高温高压、催化剂的条件下,28 g N2和 6 g H2充分反应,生成 NH3的分子数为 2nA8未考虑水解1.0 L 0.1 mol·L-1 NH4Cl 溶液中 N的个-3O4H数为 0.1nA9未考虑特殊结构(氦气是单原子分子,白磷是正四面体结构,二氧化硅、金刚石是空间网状结构)标准状况下,22.4 L 氦气含有的氦原子数为2nA1 mol 白磷分子含有的共价键数是 nA1 mol 二氧化硅中含有的硅氧键数是 2nA与量有关的离子方程式类型书写方法过量型把不足的物质当作 1 mol,足量的物质需要多少就可以提供多少(1)Ca(HCO3)2溶液与少量 NaOH 溶液反应,把 NaOH 当作 1 mol,即有 1 mol的 OH-,1 mol 的 OH-最多需要 1 mol 的 HC和 1 mol 的 Ca2+,写出离子方程式:HC+Ca2++OH- CaCO3↓+H2O(2)Ca(HCO3)2 溶液与过量 NaOH 溶液反应,把不足的 Ca(HCO3)2 当作 1 mol,即电离出 1 mol 的 Ca2+和 2 mol 的 HC,2 mol 的 HC最多需要 2 mol 的 OH- ,2HC+2OH-2H2O+2C,生成 2 mol 的 C,但只有 1 mol 的 Ca2+,生成 1 mol 的 CaCO3剩余 1 mol 的 C,最终反应的离子方程...