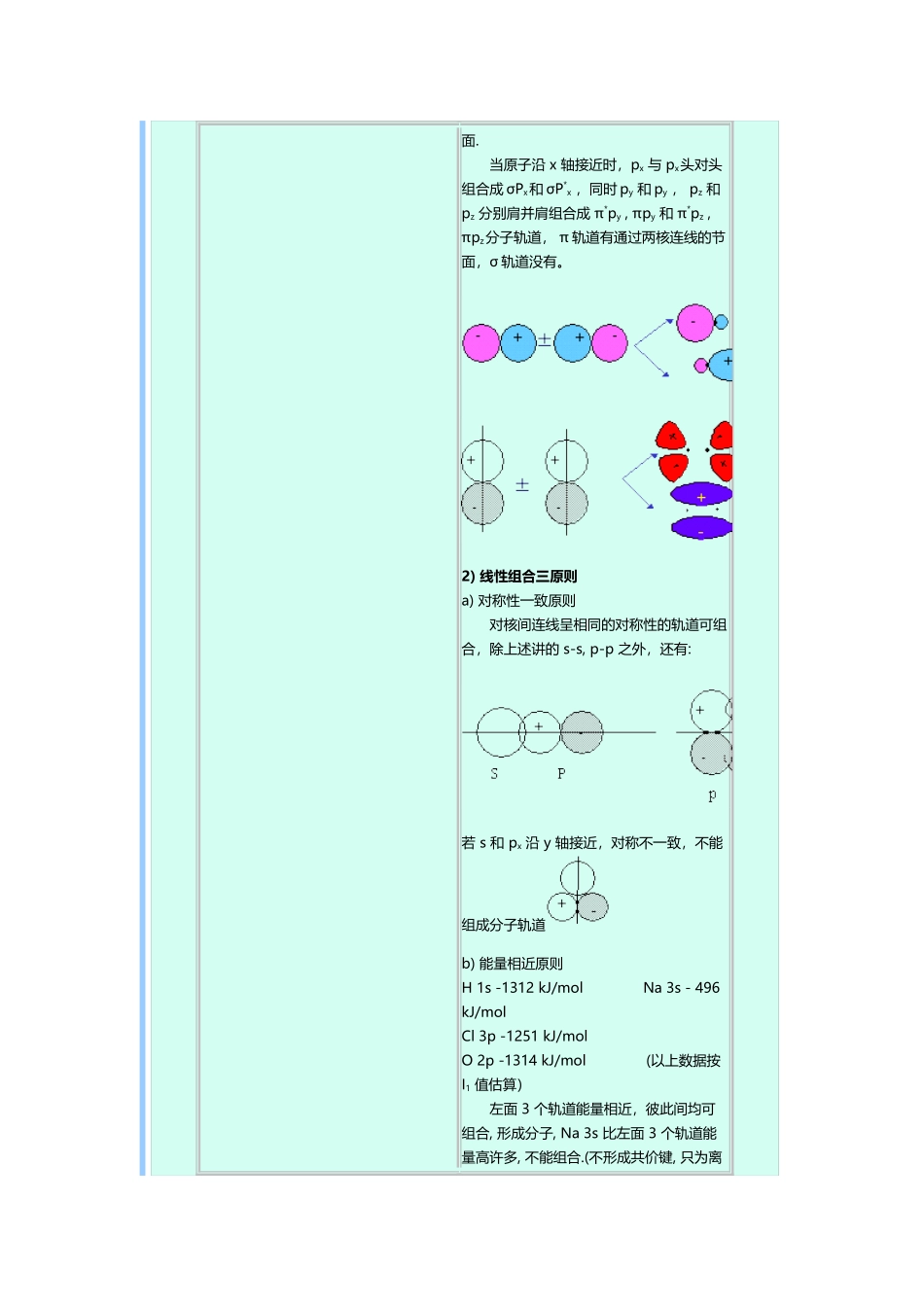
分子轨道及磁性(7 页)Good is good, but better carries it.精益求精,善益求善。 第十章 化学键与分子结构§本章摘要§1.离子键理论2.共价键理论3.金属键理论4.分子间作用力5.离子极化学说简介 §2. 共价键理论 五 分子轨道理论1. 分子轨道理论在化学键理论中的位置2. 理论要点 分子轨道理论是现代共价键理论的一个分支。其与现代共价键理论的重要区别在于,分子轨道理论认为原子轨道组合成分子轨道,电子在分子轨道中填充、运动。而现代共价键理论则讨论原子轨道,认为电子在原子轨道中运动。1) 分子轨道由原子轨道线性组合而成 分子轨道的数目与参加组合的原子轨道数目相等。H2中的两个 H 有两个1s,可组合成两个分子轨道。 两个 s 轨道只能只能 “头对头” 组合成 σ 分子轨道, MO和*MO, 能量总和与原来AO (2 个)总和相等, σ*的能量比AO 低,称为成键轨道,σ 比 AO 高,称为反键轨道。 成键轨道在核间无节面,反键轨道有节面. 当原子沿 x 轴接近时,px 与 px头对头组合成 σPx和 σP*x ,同时 py 和 py , pz 和 pz 分别肩并肩组合成 π*py , πpy 和 π*pz , πpz分子轨道, π 轨道有通过两核连线的节面,σ 轨道没有。 2) 线性组合三原则a) 对称性一致原则 对核间连线呈相同的对称性的轨道可组合,除上述讲的 s-s, p-p 之外,还有: 若 s 和 px 沿 y 轴接近,对称不一致,不能组成分子轨道b) 能量相近原则H 1s -1312 kJ/mol Na 3s - 496 kJ/molCl 3p -1251 kJ/mol O 2p -1314 kJ/mol (以上数据按 I1 值估算) 左面 3 个轨道能量相近,彼此间均可组合, 形成分子, Na 3s 比左面 3 个轨道能量高许多, 不能组合.(不形成共价键, 只为离子键)c) 最大重叠原理 在对称性一致、能量相近的基础上,原子轨道重叠越大,越易形成分子轨道, 或说共价键越强.3) 分子轨道能级图 分子轨道的能量与组成它的原子轨道能量相关,能量由低到高组成分子轨道能级图 4) 分子轨道中的电子排布 分子中的所有电子属于整个的分子,在分子轨道中依能量由低到高的次序排布,同样遵循能量最低原理,保里原理和洪特规则。 3. 同核双原子分子 1) 分子轨道能级图 A 图适用于 O2, F2 分子, B 图适用于 N2, B2, C2 等分子. 对于 N, B, C 原子, 2s 和 2p 轨道间能量差小, 相互间排斥作用大, 形成分子轨道后, σ2s 和 σ2P...