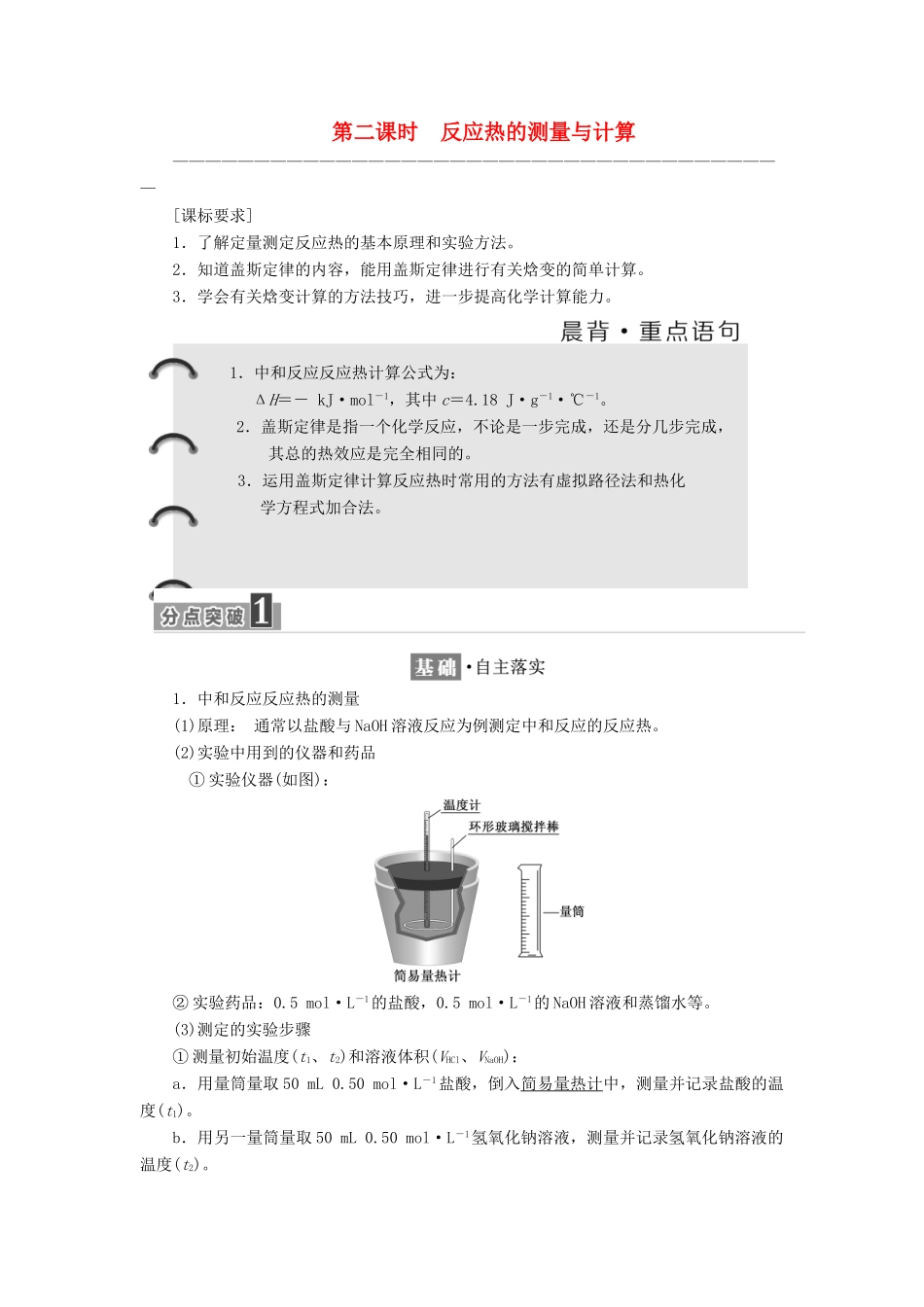
第二课时 反应热的测量与计算——————————————————————————————————————[课标要求]1.了解定量测定反应热的基本原理和实验方法。2.知道盖斯定律的内容,能用盖斯定律进行有关焓变的简单计算。3.学会有关焓变计算的方法技巧,进一步提高化学计算能力。 1.中和反应反应热计算公式为:ΔH=- kJ·mol-1,其中 c=4.18 J·g-1·℃-1。2.盖斯定律是指一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。 3.运用盖斯定律计算反应热时常用的方法有虚拟路径法和热化学方程式加合法。1.中和反应反应热的测量(1)原理: 通常以盐酸与 NaOH 溶液反应为例测定中和反应的反应热。(2)实验中用到的仪器和药品 ① 实验仪器(如图):② 实验药品:0.5 mol·L-1的盐酸,0.5 mol·L-1的 NaOH 溶液和蒸馏水等。(3)测定的实验步骤① 测量初始温度(t1、t2)和溶液体积(VHCl、VNaOH):a.用量筒量取 50 mL 0.50 mol·L-1盐酸,倒入简易量热计中,测量并记录盐酸的温度(t1)。b.用另一量筒量取 50 mL 0.50 mol·L-1氢氧化钠溶液,测量并记录氢氧化钠溶液的温度(t2)。② 测量最高温度(t3):将量筒中的氢氧化钠溶液迅速倒入盛有盐酸的简易量热计中,立即盖上盖板,用环形玻璃搅拌棒不断搅拌,观察温度计的温度变化,准确读出并记录反应体系的最高温度(t3)。 2.实验数据处理与计算ΔH=-kJ·mol-1。1.强酸与强碱的稀溶液发生中和反应的反应热 ΔH=-57.3 kJ·mol-1。分别向 1 L 0.5 mol·L-1的 NaOH 溶液中加入:①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的热效应分别为 ΔH1、ΔH2、ΔH3,它们的关系正确的是( )A.ΔH1>ΔH2>ΔH3B.ΔH2<ΔH1<ΔH3C.ΔH1=ΔH2=ΔH3D.ΔH1>ΔH3>ΔH2解析:选 D 等物质的量的 NaOH 与稀 CH3COOH、浓硫酸、稀 HNO3恰好反应生成等物质的量的水,若不考虑物质的溶解热和弱电解质电离吸热,应放出相同的热量。但在实际反应中,浓硫酸溶解放热,CH3COOH 是弱电解质,电离要吸热,故选 D。注意放热越多,ΔH 值越小。2. 某 实 验 小 组 用 50 mL 0.50 mol·L - 1NaOH 溶 液 和 30 mL 0.50 mol·L-1稀硫酸溶液进行中和反应的反应热的测定。测定稀硫酸和稀氢氧化钠反应中和热的实验装置如图所示。(1)写出该反应的热化学方程式(中和反应的反应热 ΔH=-57.3 kJ·mol-1):________________...