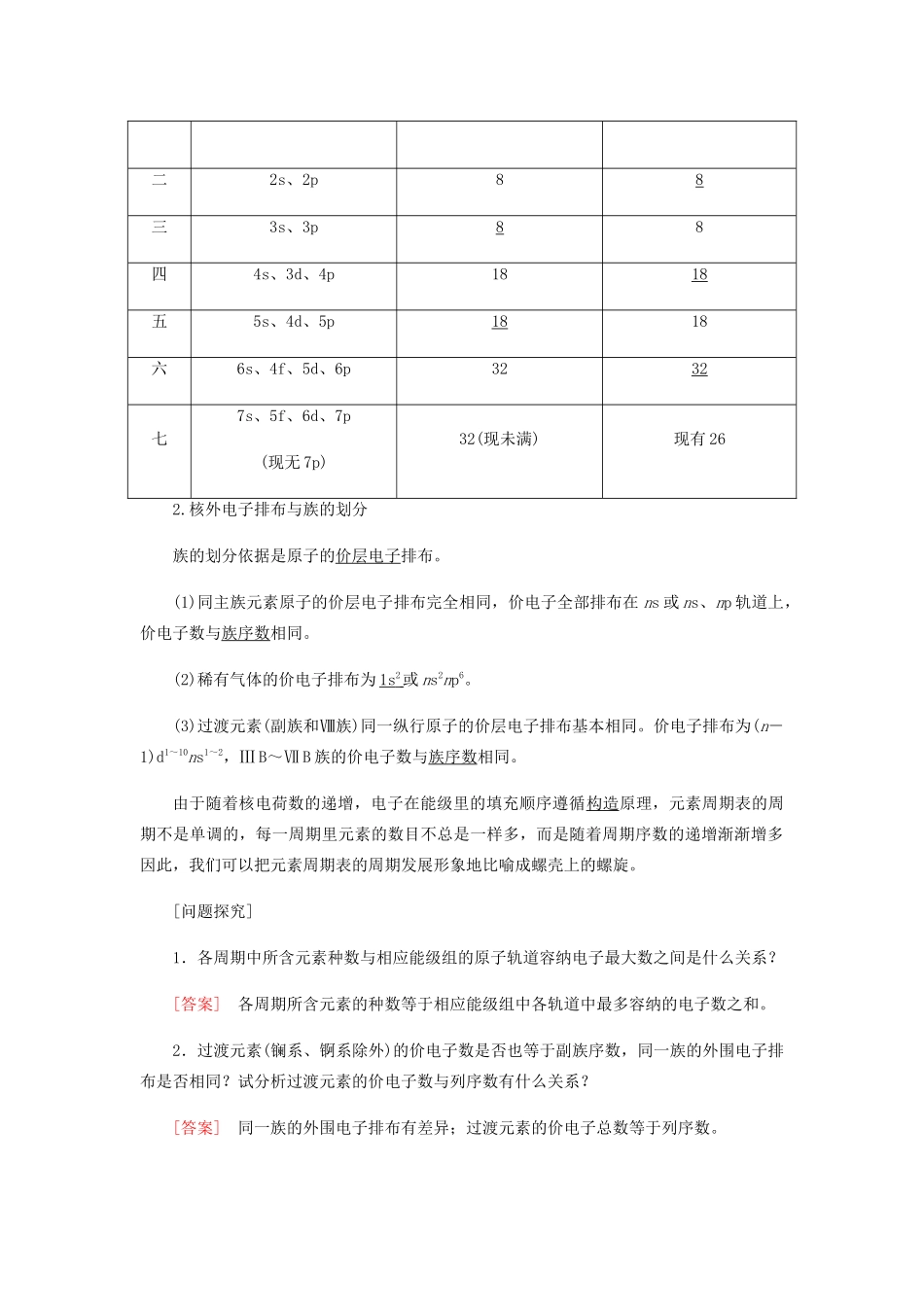
第一课时 原子结构与元素周期表学习目标:1.进一步认识周期表中原子结构和位置、价态、原子序数等之间的关系。2.知道外围电子排布和价电子层的含义。3.认识周期表中各区、各周期、各族元素原子核外电子排布规律。4.知道周期表中各区、各周期、各族元素的原子结构和位置间的关系。[知识回顾][要点梳理]1.元素周期表的结构与原子核外电子排布的特征(1)碱金属元素基态原子的电子排布式碱金属原子序数周期基态原子的电子排布式锂3二1s22s1或[He]2s1钠11三1s 2 2s 2 2p 6 3s 1 或[Ne]3s 1 钾19四1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 或[Ar]4s 1 铷37五1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1 或[Kr]5s 1 铯55六1s22s22p63s23p63d104s24p64d105s25p66s1或[Xe]6s1(2)元素周期表的形成① 形成:随着元素原子的核电荷数递增,每到出现碱金属,就开始建立一个新的电子层,随后最外层上的电子逐渐增多,最后达到 8 个电子,出现稀有气体;然后又开始由碱金属到稀有气体,如此循环往复——这就是元素周期表中的一个个周期。② 原因:元素周期表的形成是由于元素的原子核外电子的排布发生周期性的重复。③ 元素周期表中周期所含元素种类的变化规律:随着核电荷数的递增,电子在能级里的填充顺序遵循构造原理;元素周期表的周期不是单调的;每一周期里元素的数目并不总是一样多,而是随周期序号的递增渐渐增多,同时,金属元素的数目也逐渐增多。2.元素周期表的分区(1)元素周期表的分区① 按电子排布,可把周期表里的元素划分成 5 个区,分别是 s 、 p 、 d 、 ds 、 f 。② 元素周期表可分为 16 个族,其中 s 区包括Ⅰ A 、Ⅱ A ,p 区包括Ⅲ A 至Ⅶ A 、 0 族 ,ds 区包括Ⅰ B、Ⅱ B。(2)金属元素与非金属元素在元素周期表中的位置① 金属元素和非金属元素的分界线为沿 B 、 Si 、 As 、 Te 、 At 与 Al 、 Ge 、 Sb 、 Po 之间所画的一条连线,非金属性较强的元素处于元素周期表的右上角位置,金属性较强的元素处于元素周期表的左下角位置。② 处于 d 区、ds 区和 f 区的元素全部是金属元素。s 区的元素除氢外,也全部是金属元素。(3)元素周期表的特点① 元素周期表中一至六周期包含的元素种类分别为 2 、 8 、 8 、 18 、 18 、 32 ,其中金属元素种类分别为 0 、 2 、 3 、 14 、 15 、 30 。② 元素周期表...