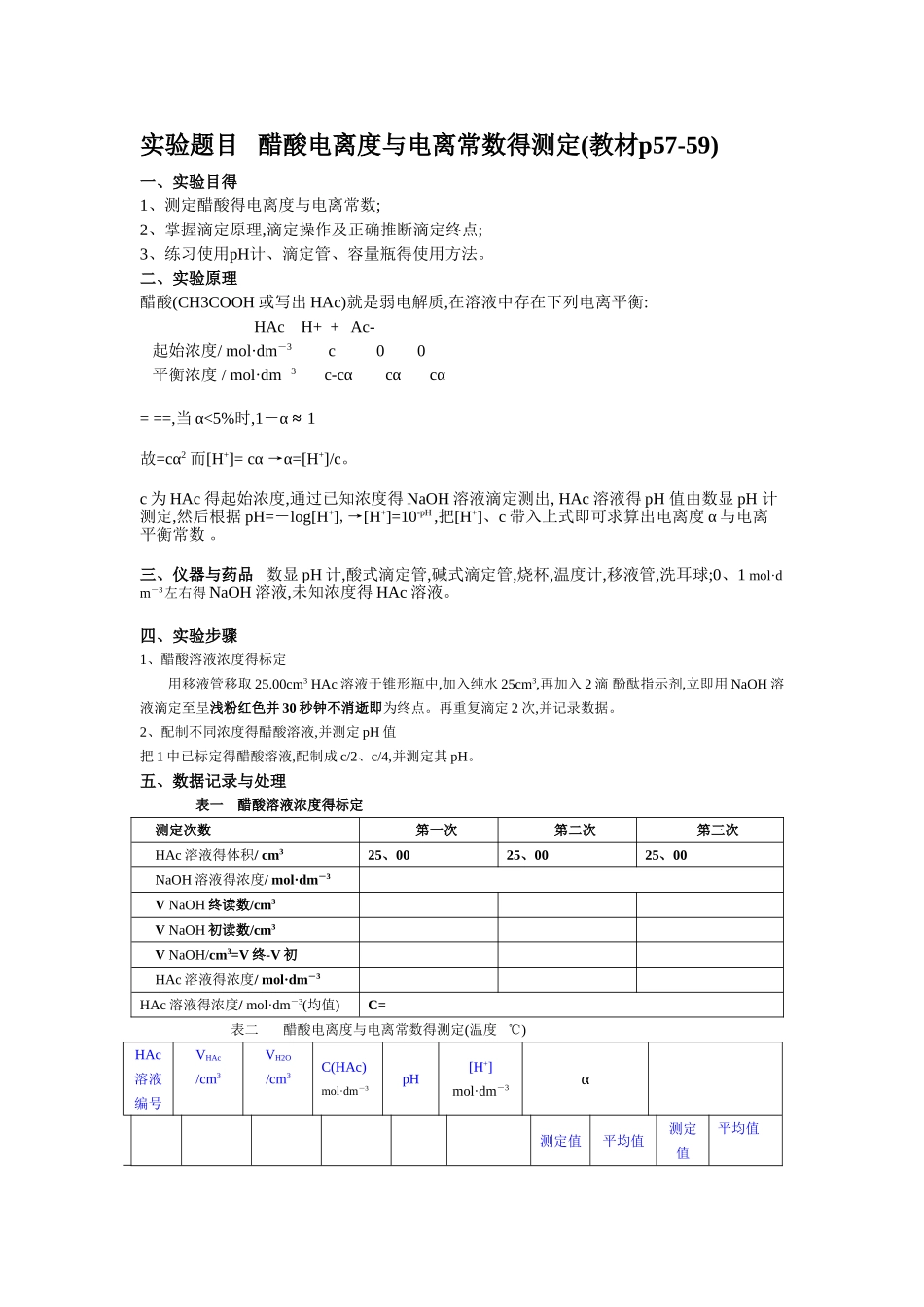
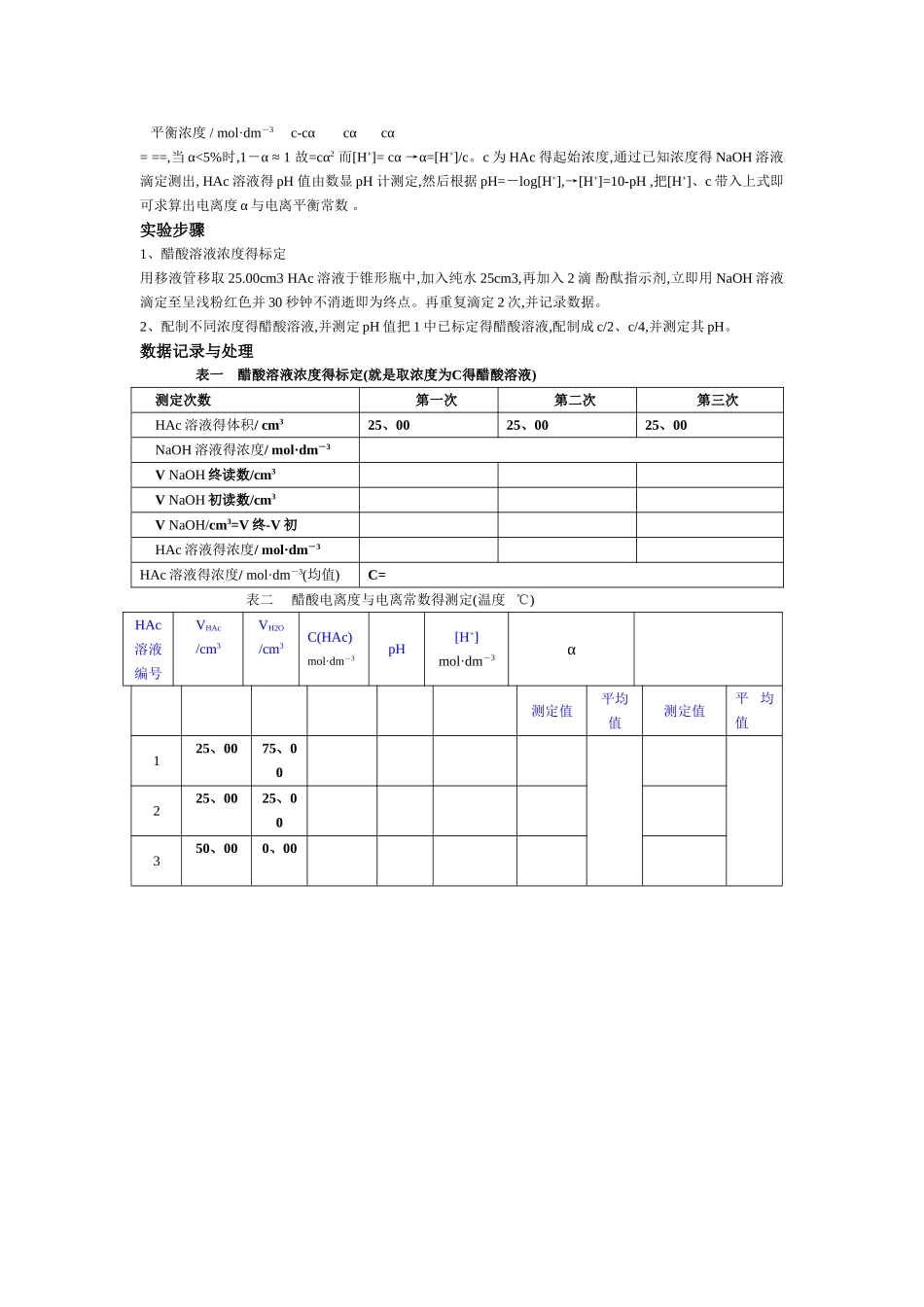
实验题目 醋酸电离度与电离常数得测定(教材p57-59)一、实验目得1、测定醋酸得电离度与电离常数;2、掌握滴定原理,滴定操作及正确推断滴定终点;3、练习使用pH计、滴定管、容量瓶得使用方法。二、实验原理醋酸(CH3COOH 或写出 HAc)就是弱电解质,在溶液中存在下列电离平衡: HAc H+ + Ac- 起始浓度/ mol·dm-3 c 0 0 平衡浓度 / mol·dm-3 c-cα cα cα = ==,当 α<5%时,1-α ≈ 1 故=cα2 而[H+]= cα →α=[H+]/c。c 为 HAc 得起始浓度,通过已知浓度得 NaOH 溶液滴定测出, HAc 溶液得 pH 值由数显 pH 计测定,然后根据 pH=-log[H+],→[H+]=10-pH ,把[H+]、c 带入上式即可求算出电离度 α 与电离平衡常数 。三、仪器与药品 数显 pH 计,酸式滴定管,碱式滴定管,烧杯,温度计,移液管,洗耳球;0、1 mol·dm-3左右得 NaOH 溶液,未知浓度得 HAc 溶液。四、实验步骤1、醋酸溶液浓度得标定用移液管移取 25.00cm3 HAc 溶液于锥形瓶中,加入纯水 25cm3,再加入 2 滴 酚酞指示剂,立即用 NaOH 溶液滴定至呈浅粉红色并 30 秒钟不消逝即为终点。再重复滴定 2 次,并记录数据。2、配制不同浓度得醋酸溶液,并测定 pH 值把 1 中已标定得醋酸溶液,配制成 c/2、c/4,并测定其 pH。五、数据记录与处理表一 醋酸溶液浓度得标定测定次数 第一次 第二次 第三次HAc 溶液得体积/ cm325、0025、0025、00NaOH 溶液得浓度/ mol·dm-3V NaOH 终读数/cm3V NaOH 初读数/cm3V NaOH/cm3=V 终-V 初HAc 溶液得浓度/ mol·dm-3HAc 溶液得浓度/ mol·dm-3(均值)C=表二 醋酸电离度与电离常数得测定(温度 ℃)HAc溶液编号VHAc/cm3VH2O/cm3C(HAc)mol·dm-3pH [H+]mol·dm-3α测定值平均值测定值平均值125、0075、00225、0025、00350、000、00六、结果与讨论(就是对实验结果进行讨论,分析结果就是偏大还就是偏小得原因)以上就就是正式实验报告得格式!注意事项:请仔细瞧书(近代化学实验教材p9-12)(一)、醋酸溶液浓度得标定1、正确选用所需仪器(25cm3移液管,碱式滴定管,烧杯,洗耳球,锥形瓶,洗瓶等)2、·查漏——检查滴定管就是否漏液;·润洗——分别用自来水、蒸馏水、待取液(NaOH 溶液)洗滴定管 3 次;分别用自来水、蒸馏水、HAc 溶液洗移液管 3 次·装液——在碱式滴定管中装满 NaOH 溶液,固定在滴定管夹上,除去尖嘴部分气泡,调整液面至零刻度或零刻度以下,并记录数据;用移液管移取 2...