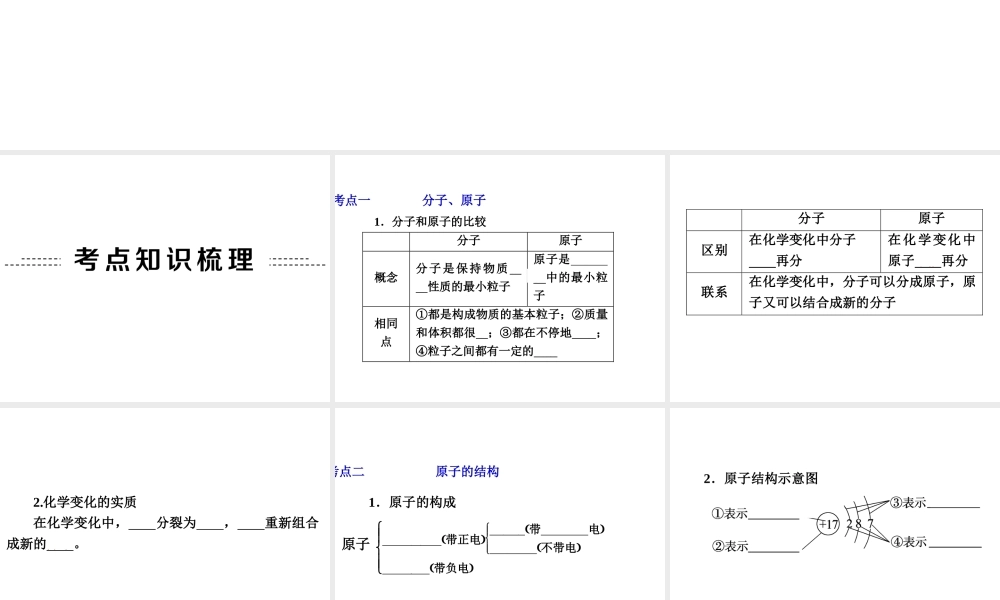
第 4 讲 分子、原子、离子及元素1.分子和原子的比较 分子 原子 概念 分子是保持物质化学性质的最小粒子 原子是化学变化中的最小粒子 相同点 ①都是构成物质的基本粒子;②质量和体积都很小;③都在不停地运动;④粒子之间都有一定的间隔 考点一 分子、原子 分子 原子 区别 在化学变化中分子 可以再分 在化学变化中原子不能再分 联系 在化学变化中,分子可以分成原子,原子又可以结合成新的分子 2.化学变化的实质 在化学变化中,分子分裂为原子,原子重新组合成新的分子。 1.原子的构成 原子 考点二 原子的结构 原子核 带正电 质子带 正 电 中子 不带电 电子 带负电 2.原子结构示意图 3.相对原子质量 以一个碳原子质量的 1/12 为标准,其他原子质量跟它相比较所得的值,叫做这种原子的相对原子质量。相对原子质量的单位是 1,相对原子质量越大,原子的实际质量越大;两种原子的相对原子质量之比等于这两种原子的质量比。 温馨提示: 1.原子中不一定有中子,如氢原子核内无中子。 2.在原子中,核电荷数=质子数=核外电子数。 3.相对原子质量≈质子数+中子数。 1.概念 离子是带电的原子或原子团)。 2.原子与离子的区别和联系 考点三 离 子 1.概念 元素是质子数(即核电荷数)相同的一类原子的总称。 2.分布 (1)空气中含量居前 2 位的元素分别为氮、氧。 (2)地壳中含量居前 5 位的元素分别为氧、硅、铝、铁、钙。 考点四 元 素 (3)人体中含量居前 4 位的元素分别是氧、碳、氢、氮。 3.元素符号 (1)书写:第 1 个字母大写,第 2 个字母小写。 (2)意义:宏观上表示一种元素; 微观上表示该元素的一个原子。 温馨提示: 1.金属、固态非金属及稀有气体的元素符号还可以表示该物质。 2.当元素符号前有数字时,该符号只具有微观意义。 4.元素与原子的区别与联系 1.元素周期表合理有序地对所有已知元素进行了排列。表中每一横行表示一个周期,从左到右元素的电子层数不变,核电荷数逐渐变大;每一竖列表示一个族,从上到下元素的电子层数逐渐增多,化学性质相似。 2.原子序数=质子数(或核电荷数);周期数=电子层数。 考点五 元素周期表 3.每一格信息(以硫元素为例) 例 1 (2013·雅安)对生活中下列现象的解释错误的是( ) 现象解释A湿衣服在夏天比在冬天干得快温度升高,分子运动速率加快B6000 L 氧气在加压...