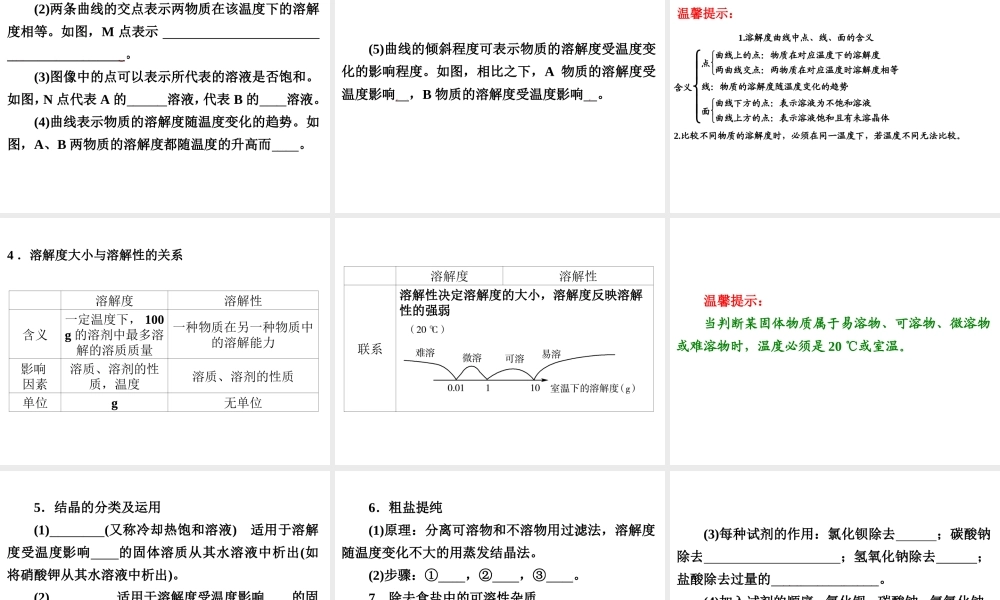
第 15 讲海水“制镁、晒盐、制碱”考点一 海洋化学资源 1.海水中的物质 海水中含有较多的物质是水和盐。在海水中,溶解的盐的含量占 3.5%;最多的金属离子是 Na+和 Mg2+,最多的非金属离子是 Cl-,形成的化合物分别是 NaCl、MgCl2。 2.海水制取镁 (1)流程 海水或卤水 ――→石灰乳操作Ⅰ 氢氧化镁 ――→盐酸操作Ⅱ 氯化镁 ――→通电镁 (2)有关反应原理 ①MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2; ②Mg(OH)2+2HCl===MgCl2+2H2O; ③MgCl2=====通电 Mg+Cl2↑。 (3)有关操作:流程图中操作Ⅰ为过滤,操作Ⅱ为蒸发。 3.海底矿物 (1)新型矿产资源——天然气水合物(或可燃冰),被科学家誉为“未来能源”、“21 世纪能源”。 (2)常规化石燃料:煤、石油、天然气。 (3)海底金属矿物——多金属结核,也称锰结核。 4.海水淡化 主要方法是热法和膜法。热法中常用的有低温多效蒸馏法和多级闪急蒸馏法。 考点二 海水晒盐 1.海水晒盐 (1)原理:蒸发结晶 (2)流程:海水→蒸发池→结晶池→粗盐、母液 2.溶解度 (1)定义:在一定温度下,某固体物质在 100_g 溶剂里达到饱和状态时所能溶解的质量,叫做该物质在这种溶剂里的溶解度。 (2)影响固体物质溶解度大小的因素 ①内部因素:溶质和溶剂本身的性质; ②外部因素:温度。 a.大多数物质的溶解度随温度的升高而增大,如:硝酸钾。 b.少数物质的溶解度受温度的影响变化不大,如:氯化钠。 c.极少数物质的溶解度随温度的升高而降低,如:氢氧化钙。 (3)影响气体溶解度大小的因素 ①内部因素:溶质和溶剂本身的性质; ②外部因素:温度和压强 随温度的升高而减小,随压强的增大而增大。 (4)固体物质溶解度的含义 例如:“20 ℃时,氯化钠的溶解度是 36 g”的含义是:①在 20 ℃时,100g 水中溶解 36g 氯化钠,溶液达到饱和;②在 20 ℃时,100 g 水中最多溶解 36 g氯化钠。 温馨提示: (1)曲线上的点表示物质在该温度下的溶解度。如图,P 点表示 20℃时,A 的溶解度为 10g。 (2)两条曲线的交点表示两物质在该温度下的溶解度相等。如图,M 点表示 40℃时,A、B 两物质的溶解度相等,都为 15g。 (3)图像中的点可以表示所代表的溶液是否饱和。如图,N 点代表 A 的不饱和溶液,代表 B 的饱和溶液。 (4)曲线表示物质的溶解度随温度变化的趋势。如图,A、B 两物质的溶解度都随温度的升高而增大。 (5)曲线的倾斜程度可表...