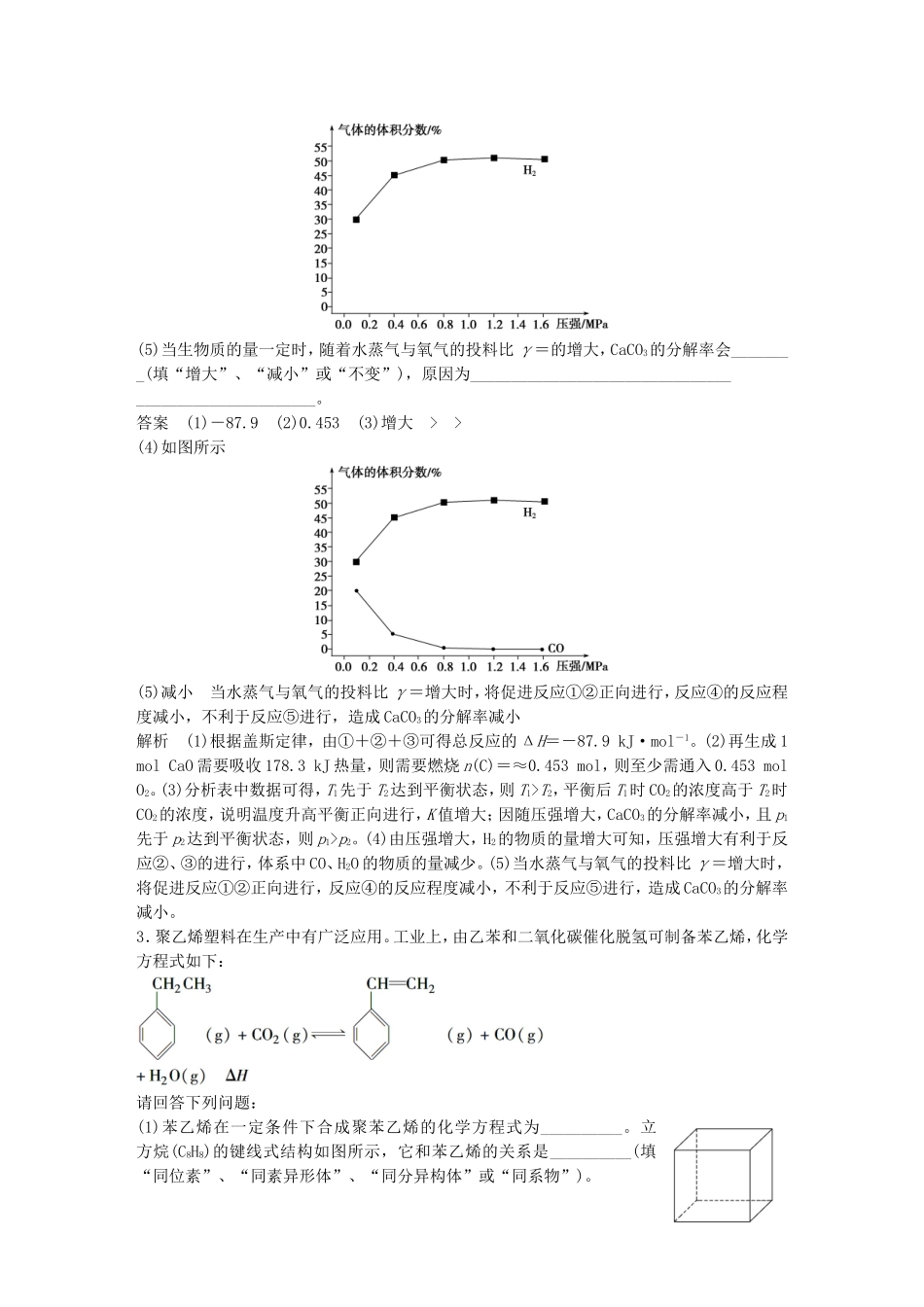
第31题化学基本理论综合题题组一以生产科研为背景的综合题1.以CH4和H2O为原料制备甲醇的相关反应如下:Ⅰ.CH4(g)+H2O(g)CO(g)+3H2(g)ΔH=+206.0kJ·mol-1Ⅱ.CO(g)+2H2(g)CH3OH(g)ΔH=-129.0kJ·mol-1(1)写出CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式:__________________。(2)若在100℃时,将1.0molCH4(g)和2.0molH2O(g)充入100L真空的密闭密器中,在一定条件下发生反应Ⅰ,每隔一段时间对该容器内的物质进行分析,得到如表所示数据:时间(min)02468n(CH4)/mol1.0n10.4n3n4n(H2O)/mol2.01.6n21.21.2①在上述条件下,从反应开始直至2min时,用CH4表示该反应的平均反应速率为________。②n1=________mol,n2=________mol,n3________n4(填“>”、“<”或“=”)。③100℃时,反应Ⅰ的平衡常数为________(保留2位有效数字)。(3)在压强为0.1MPa、温度为200℃的条件下,将2.0molCO与3.0molH2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的,其他条件不变,下列说法中正确的是________。A.平衡常数K增大B.正反应速率增大,逆反应速率减小C.CH3OH的物质的量增加D.重新平衡时c(H2)/c(CH3OH)减小(4)工业上利用甲醇制备氢气的常用方法有两种:①甲醇蒸气重整法。该方法的主要反应为CH3OH(g)CO(g)+2H2(g),此反应能自发进行的原因是__________________。②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂,原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当=0.25时,CH3OH与O2发生的主要反应的化学方程式为______________。答案(1)CH4(g)+H2O(g)CH3OH(g)+H2(g)ΔH=+77.0kJ·mol-1(2)①0.002mol·L-1·min-1②0.61.4=③4.6×10-3(3)CD(4)①该反应是一个熵增加的反应,即ΔS>0②2CH3OH+O2――→2HCHO+2H2O解析(1)Ⅰ式与Ⅱ式相加得CH4(g)+H2O(g)CH3OH(g)+H2(g)ΔH=+77.0kJ·mol-1。(2)用H2O表示的该反应的平均反应速率v(H2O)=0.4mol÷100L÷2min=0.002mol·L-1·min-1,则用CH4表示的该反应的平均反应速率v(CH4)=v(H2O)=0.002mol·L-1·min-1。根据反应方程式计算可得n1=0.6mol,n2=1.4mol,再根据表中的数据可知6~8min反应已达到平衡,故n3=n4。(3)反应Ⅱ的正反应是气体体积减小的反应,减小体系体积相当于增大压强,正、逆反应速率均加快,但正反应速率增大得更快,平衡向正反应方向移动,CH3OH的物质的量增加;根据化学平衡移动原理可知,重新达到平衡时,减小;平衡常数仅与温度有关,增大压强,平衡常数K不变;综上分析,C、D项正确。(4)①该反应为分解反应,反应的ΔH>0,反应能自发进行,说明该反应的ΔS>0。②分析坐标图可知,当=0.25时,CH3OH与O2反应主要生成HCHO。2.由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向。如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C)。其中气化炉和燃烧炉中分别发生的主要反应如表所示:气化炉燃烧炉①C(s)+H2O(g)CO(g)+H2(g)ΔH=+131.6kJ·mol-1②CO(g)+H2O(g)CO2(g)+H2(g)ΔH=-41.2kJ·mol-1③CaO(s)+CO2(g)CaCO3(s)ΔH=-178.3kJ·mol-1④C(s)+O2(g)===CO2(g)ΔH=-393.8kJ·mol-1⑤CaCO3(s)===CaO(s)+CO2(g)K请回答下列问题:(1)气化炉中的总反应为C(s)+2H2O(g)+CaO(s)===CaCO3(s)+2H2(g)ΔH=________kJ·mol-1。(2)燃烧炉中反应⑤所需的能量由反应④提供。如果生成1molCaO,至少需通入纯氧________mol。(3)下表列出的是当只改变温度或压强时,反应⑤中CO2的浓度和CaCO3的残留率的变化。\s\up25(时间/min)0510152025T101.52.34.04.04.0T201.01.82.83.13.1\s\up25(时间/min)0510152025p110.900.830.750.750.75p210.580.350.310.300.30由表中数据可知,随着温度升高,反应⑤K值________(填“增大”、“减小”或“不变”),T1________T2(填“>”或“<”,下同);随着压强增大,CaCO3的分解率减小,则p1________p2。(4)在一定温度、压强时,H2的变化量等于CO的变化量,当气化炉内压强增大时,H2的含量会明...