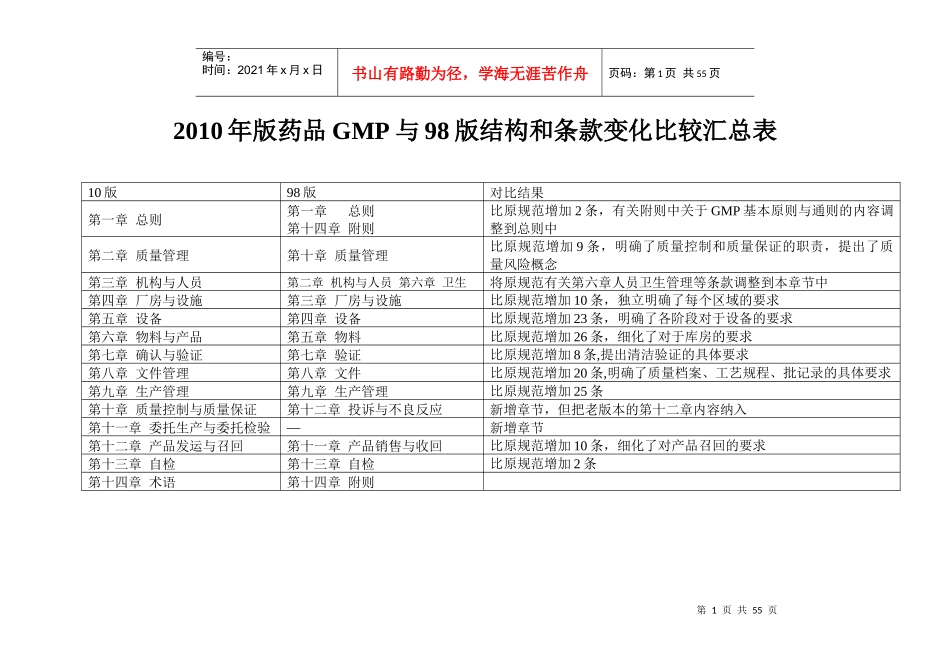
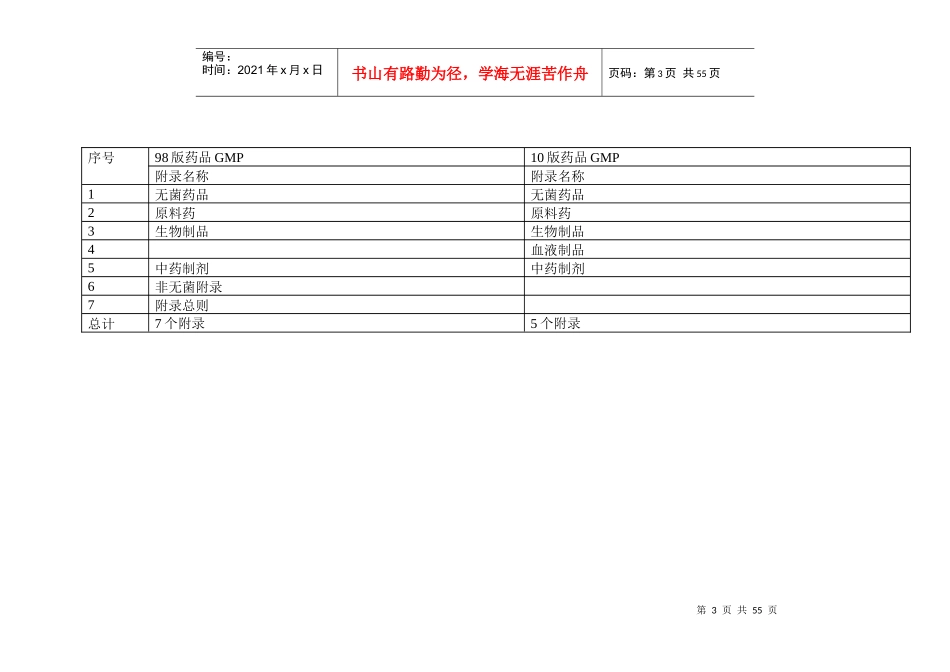
第1页共55页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第1页共55页2010年版药品GMP与98版结构和条款变化比较汇总表10版98版对比结果第一章总则第一章总则第十四章附则比原规范增加2条,有关附则中关于GMP基本原则与通则的内容调整到总则中第二章质量管理第十章质量管理比原规范增加9条,明确了质量控制和质量保证的职责,提出了质量风险概念第三章机构与人员第二章机构与人员第六章卫生将原规范有关第六章人员卫生管理等条款调整到本章节中第四章厂房与设施第三章厂房与设施比原规范增加10条,独立明确了每个区域的要求第五章设备第四章设备比原规范增加23条,明确了各阶段对于设备的要求第六章物料与产品第五章物料比原规范增加26条,细化了对于库房的要求第七章确认与验证第七章验证比原规范增加8条,提出清洁验证的具体要求第八章文件管理第八章文件比原规范增加20条,明确了质量档案、工艺规程、批记录的具体要求第九章生产管理第九章生产管理比原规范增加25条第十章质量控制与质量保证第十二章投诉与不良反应新增章节,但把老版本的第十二章内容纳入第十一章委托生产与委托检验—新增章节第十二章产品发运与召回第十一章产品销售与收回比原规范增加10条,细化了对产品召回的要求第十三章自检第十三章自检比原规范增加2条第十四章术语第十四章附则第2页共55页第1页共55页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第2页共55页序号98版药品GMP基本要求10版药品GMP基本要求比较10版/98版(字数增加倍数)章节名称字数章节名称字数1总则87总则3704.32--质量管理1548内容实为新增,体现质量管理体系的要求3机构与人员392机构与人员26066.64厂房与设施1749厂房与设施25751.55设备493设备18853.86物料747物料与产品28703.87卫生575--分别归到人员、厂房与设施、设备各章节中8验证255确认与验证10324.09文件803文件管理38284.810生产管理963生产管理23522.411质量管理398质量控制与质量保证808620.312--委托生产与委托检验1111新增13产品销售与收回270产品发运与召回6802.514投诉与不良反应报告142--投诉归入质量控制与质量保证,不良反应删除15自检145自检3112.116附则术语11/570术语术语44/2458术语条数4字数4.3总计十四章88条7589十四章316条31712条款3.6/字数4.2第3页共55页第2页共55页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第3页共55页序号98版药品GMP10版药品GMP附录名称附录名称1无菌药品无菌药品2原料药原料药3生物制品生物制品4血液制品5中药制剂中药制剂6非无菌附录7附录总则总计7个附录5个附录第4页共55页第3页共55页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第4页共55页2010版GMP与98版GMP条款对比第一章总则(2010)第一章总则(98)编号条款编号条款1为规范药品生产质量管理,根据《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》,制定本规范。1根据《中华人民共和国药品管理法》规定,制定本规范。2企业应当建立药品质量管理体系。该体系应当涵盖影响药品质量的所有因素,包括确保药品质量符合预定用途的有组织、有计划的全部活动。3本规范作为质量管理体系的一部分,是药品生产管理和质量控制的基本要求,旨在最大限度地降低药品生产过程中污染、交叉污染以及混淆、差错等风险,确保持续稳定地生产出符合预定用途和注册要求的药品。2本规范是药品生产和质量管理的基本准则。适用于药品制剂生产的全过程、原料药生产中影响成品质量的关键工序。4企业应当严格执行本规范,坚持诚实守信,禁止任何虚假、欺骗行为。第5页共55页第4页共55页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第5页共55页第二章质量管理(2010)第十章质量管理(98)编号条款编号条款第一节原则5企业应当建立符合药品质量管理要求的质量目标,将药品注册的有关安全、有效和质量可控的所有要求,系统地贯彻到药品生产、控制及产品放行、贮存、发运的全过程中,确保所生产的药品符合预定用途和注册要求。74药品生产企业的质量管理部门应负责药品生产全过程的质量管理和检...