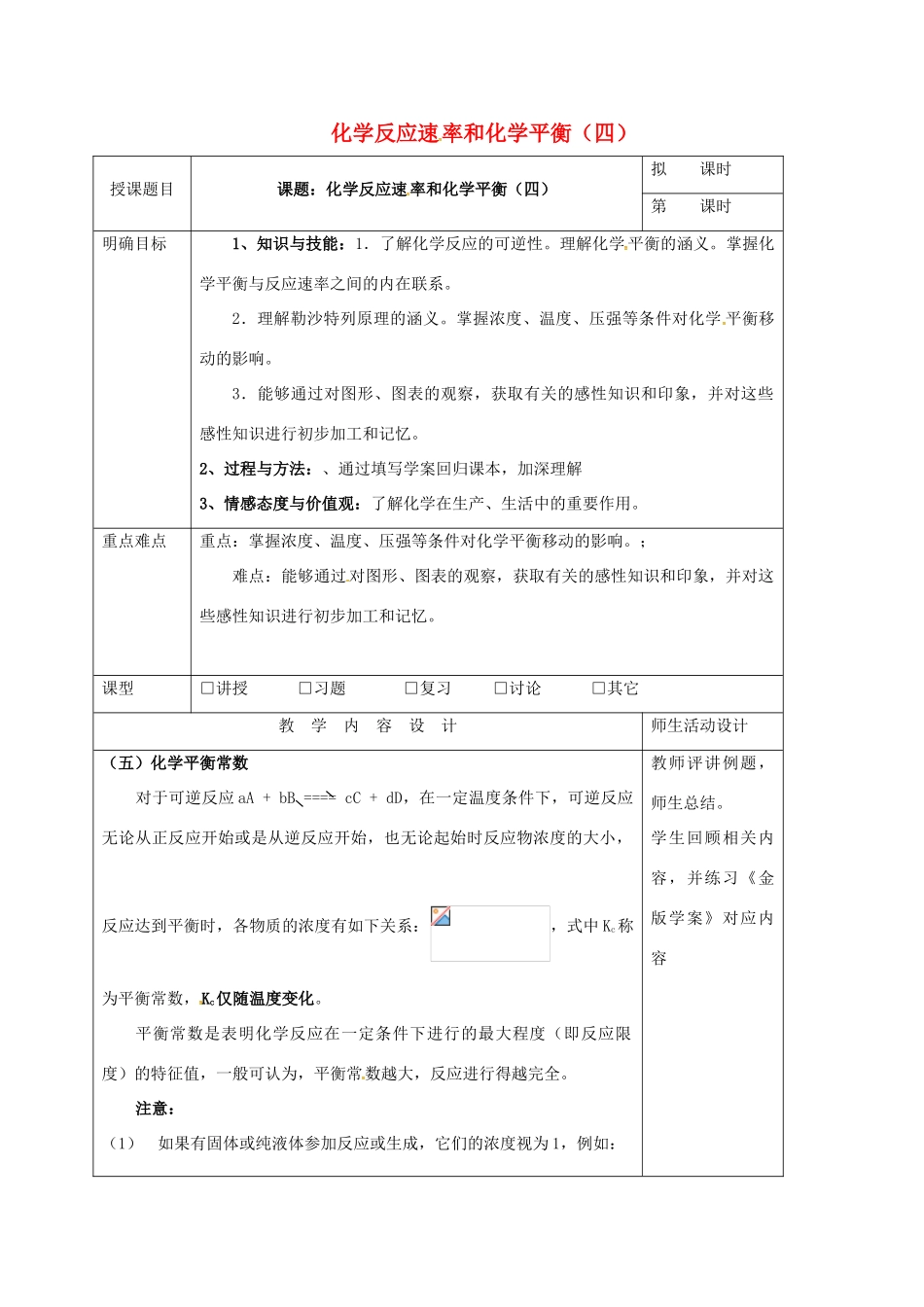
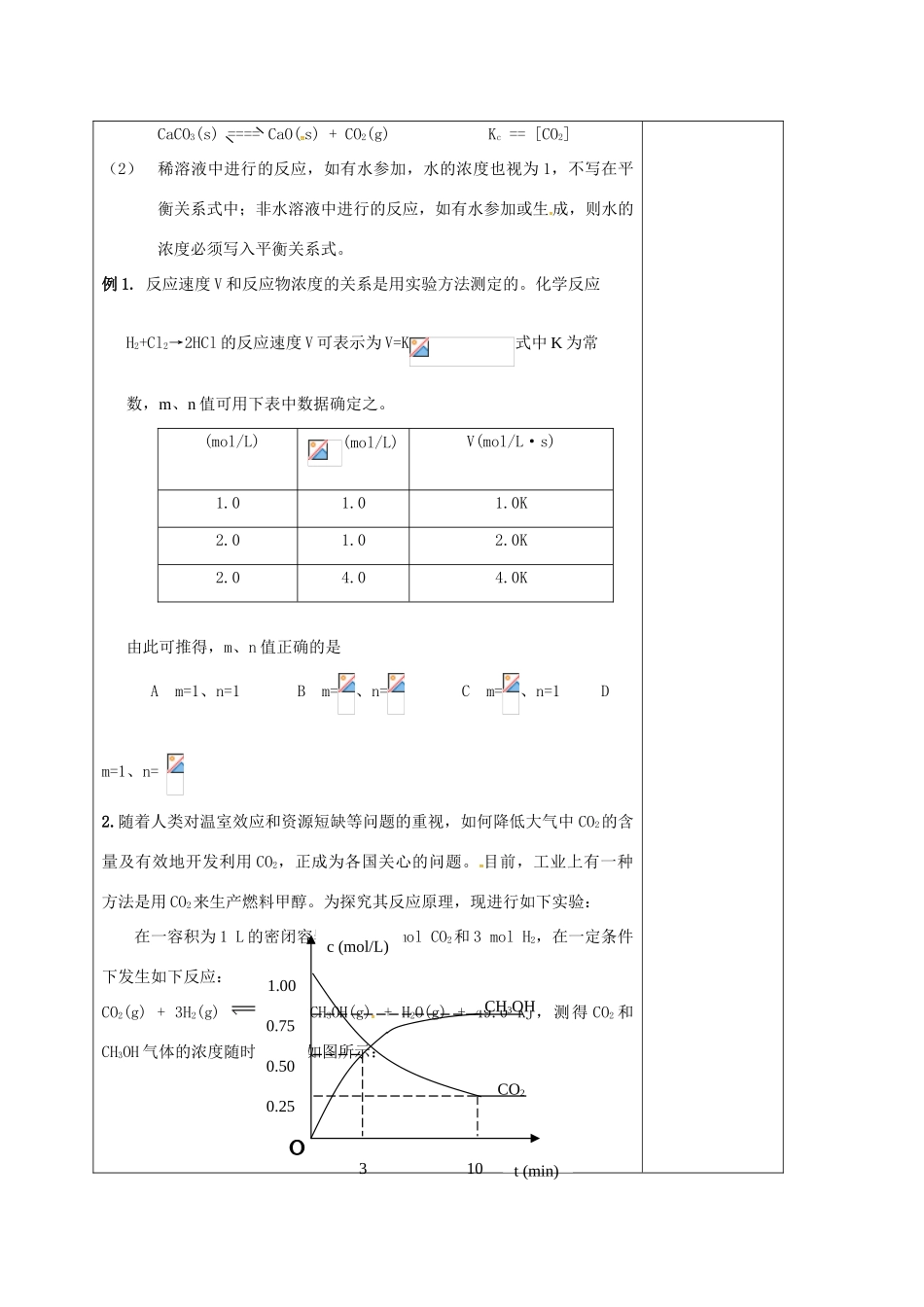
化学反应速率和化学平衡(四)授课题目课题:化学反应速率和化学平衡(四)拟课时第课时明确目标1、知识与技能:1.了解化学反应的可逆性。理解化学平衡的涵义。掌握化学平衡与反应速率之间的内在联系。2.理解勒沙特列原理的涵义。掌握浓度、温度、压强等条件对化学平衡移动的影响。3.能够通过对图形、图表的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆。2、过程与方法:、通过填写学案回归课本,加深理解3、情感态度与价值观:了解化学在生产、生活中的重要作用。重点难点重点:掌握浓度、温度、压强等条件对化学平衡移动的影响。;难点:能够通过对图形、图表的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆。课型□讲授□习题□复习□讨论□其它教学内容设计师生活动设计(五)化学平衡常数对于可逆反应aA+bB====cC+dD,在一定温度条件下,可逆反应无论从正反应开始或是从逆反应开始,也无论起始时反应物浓度的大小,反应达到平衡时,各物质的浓度有如下关系:,式中Kc称为平衡常数,Kc仅随温度变化。平衡常数是表明化学反应在一定条件下进行的最大程度(即反应限度)的特征值,一般可认为,平衡常数越大,反应进行得越完全。注意:(1)如果有固体或纯液体参加反应或生成,它们的浓度视为1,例如:教师评讲例题,师生总结。学生回顾相关内容,并练习《金版学案》对应内容CaCO3(s)====CaO(s)+CO2(g)Kc==[CO2](2)稀溶液中进行的反应,如有水参加,水的浓度也视为1,不写在平衡关系式中;非水溶液中进行的反应,如有水参加或生成,则水的浓度必须写入平衡关系式。例1.反应速度V和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速度V可表示为V=K式中K为常数,m、n值可用下表中数据确定之。(mol/L)(mol/L)V(mol/L·s)1.01.01.0K2.01.02.0K2.04.04.0K由此可推得,m、n值正确的是Am=1、n=1Bm=、n=Cm=、n=1Dm=1、n=2.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,正成为各国关心的问题。目前,工业上有一种方法是用CO2来生产燃料甲醇。为探究其反应原理,现进行如下实验:在一容积为1L的密闭容器中充入1molCO2和3molH2,在一定条件下发生如下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+49.0KJ,测得CO2和CH3OH气体的浓度随时间变化如图所示:t(min)c(mol/L)3100.250.500.751.00CH3OHCO2(1)反应开始至达到化学平衡时,氢气平均反应速率v(H2)为____________mol/(L·min)。(2)该反应的平衡常数表达式为______________________,K值越大,表示__________________________________________,对于此反应,温度升高,K值_______________(填“增大”、“减小”或“不变”)。(3)下列措施中,能使增大的是____________(填编号)。A.升高温度B.充入氦气,使体系压强增大C.将H2O(g)从体系中分离出来D.再充入1molCO2和3molH2(4)根据你所掌握的知识,你认为还可用于降低大气中CO2的含量及有效地开发利用CO2的方法有(写出一种)_________________________________________________________。因材施教:教学后记:当有非气体物质参与时晨时