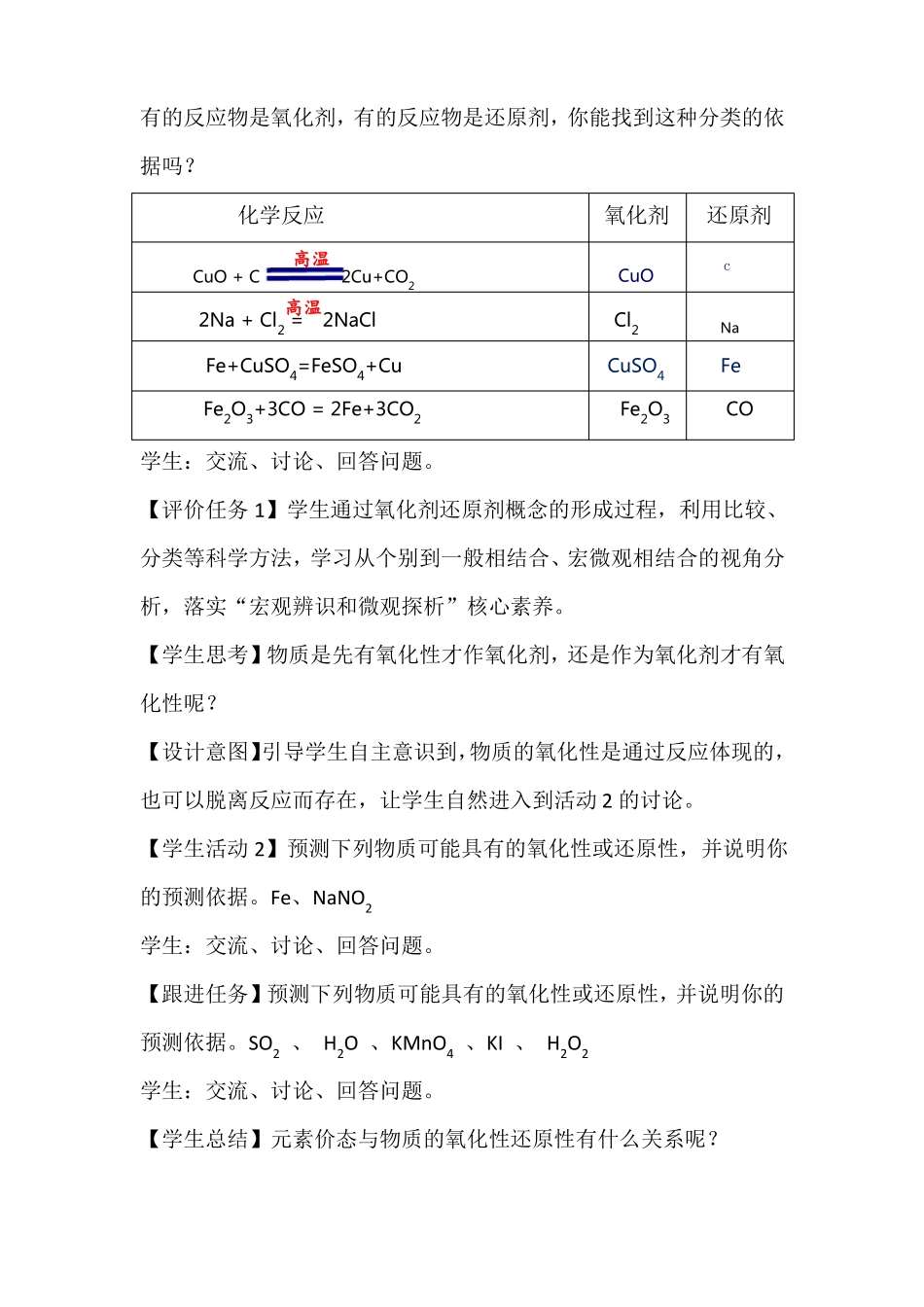
《氧化剂和还原剂》教学设计一、教学分析1、教材分析“氧化还原反应”是高中化学必修课程中概念原理类内容,是高一年级全体学生都要学习的重点知识。《氧化还原反应》在高中化学中占有极其重要的地位,贯穿于高中化学教材的始终,是高中化学教学的重难点之一。该部分教学内容可安排3个课时,本节《氧化剂和还原剂》是第2课时。2、学情分析知识水平:学生在第1课时已经学习了氧化还原反应的概念并复习了化合价知识,知道了氧化还原反应的特征和本质,知道了氧化还原反应的判断方法。能力水平:高一新生具备了一定的处理信息能力,但对于小组合作学习、交流及语言表达能力、科学探究的一般过程和方法及实验操作能力都有待提高。二、教学与评价目标1、教学目标(1)通过比较、分类等科学方法,了解氧化剂、还原剂的定义及概念间的联系。(2)通过预测物质的氧化性和还原性,进一步提升知识概括水平和总结能力,初步形成预测物质性质的一般思路和方法。(3)通过设计实验并进行实验验证H2O2的性质,增强小组合作实验探究,体会科学探究的一般过程和方法。2、评价目标(1)通过氧化剂还原剂概念的形成过程,学习从个别到一般相结合、宏微观相结合的视角分析,认同科学方法对化学研究和学习的重要作用,体会化学学科的认知功能和应用价值,激发学习兴趣,落实“宏观辨识和微观探析”核心素养。(2)通过对物质性质的预测和分析,诊断并发展学生对氧化还原本质的认识水平和认识思路结构化水平,落实“证据推理和模型认知”核心素养。(3)通过对H2O2性质的探究实验设计方案的交流和点评,诊断并发展学生的实验探究水平(定性水平),落实“科学探究与创新意识”核心素养、“证据推理与模型认知”核心素养。三、教学重难点1、教学重点:氧化剂、还原剂相关概念及概念间的联系。2、教学难点:预测物质性质一般思路的建立四、教学策略及方法为了突出重点突破难点,充分调动学生的积极性,本节采用问题教学法:即通过设计富有驱动性、环环相扣的问题,让学生思考、讨论、归纳、总结,在解决问题的过程中逐步将学生的认知引向深入。五、教学过程【学生活动1】认识氧化剂、还原剂。教师:这是上节课我们研究过的4个氧化还原反应。在这4个反应中,有的反应物是氧化剂,有的反应物是还原剂,你能找到这种分类的依据吗?化学反应高温氧化剂还原剂CuO+C2Cu+CO2CuOc高温2Na+Cl2=2NaClCl2NaFe+CuSO4=FeSO4+CuCuSO4FeFe2O3+3CO=2Fe+3CO2Fe2O3CO学生:交流、讨论、回答问题。【评价任务1】学生通过氧化剂还原剂概念的形成过程,利用比较、分类等科学方法,学习从个别到一般相结合、宏微观相结合的视角分析,落实“宏观辨识和微观探析”核心素养。【学生思考】物质是先有氧化性才作氧化剂,还是作为氧化剂才有氧化性呢?【设计意图】引导学生自主意识到,物质的氧化性是通过反应体现的,也可以脱离反应而存在,让学生自然进入到活动2的讨论。【学生活动2】预测下列物质可能具有的氧化性或还原性,并说明你的预测依据。Fe、NaNO2学生:交流、讨论、回答问题。【跟进任务】预测下列物质可能具有的氧化性或还原性,并说明你的预测依据。SO2、H2O、KMnO4、KI、H2O2学生:交流、讨论、回答问题。【学生总结】元素价态与物质的氧化性还原性有什么关系呢?学生:交流、讨论、回答问题。【评价任务2】学生自主总结出根据物质所含元素化合价升降的可能性来预测物质可能具有的氧化性或还原性,内化学生依据物质中所含元素化合价升降趋势来预测物质具有的氧化性或者还原性的角度和思路,落实“证据推理和模型认知”核心素养。【学生活动3】设计实验方案验证H2O2的氧化性和还原性。教师:我们已经从化合价升降角度预测了H2O2既有氧化性又有还原性,如何通过实验证明H2O2的氧化性和还原性呢?请同学们设计相应实验方案,并预测产物和实验现象。(提示:碘单质遇淀粉变蓝)学生:交流、讨论、回答问题。【学生实验】实验1目的:验证H2O2具有氧化性。实验步骤:将淀粉-KI试纸置于表面皿上,滴加H2O2溶液,观察试纸的颜色。实验2目的:验证H2O2具有还原性。实验步骤:向试管中先加入2ml酸性高锰酸钾溶液,再滴加5滴H2O2溶...