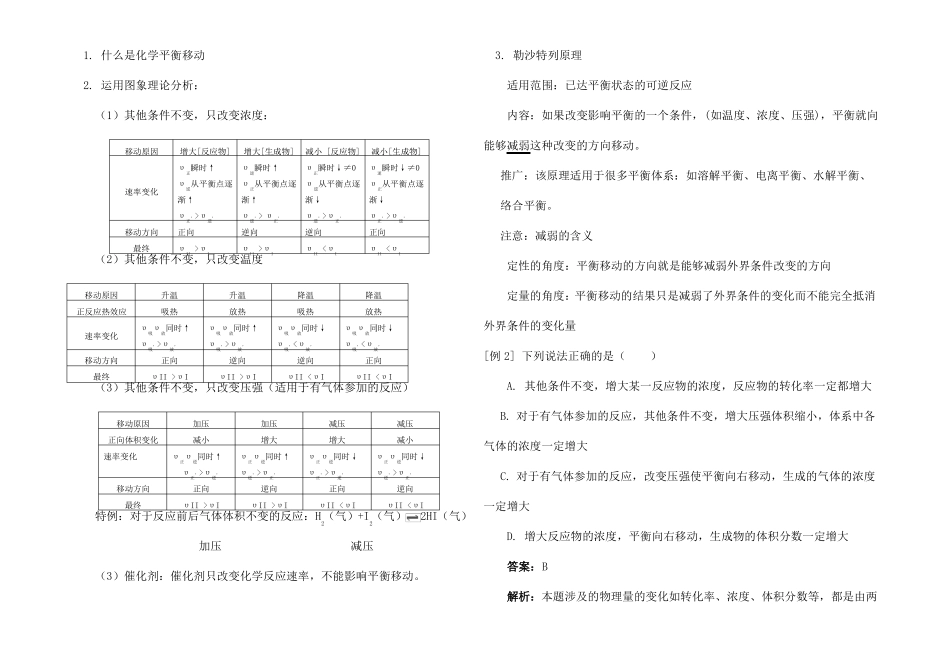
嘴哆市安排阳光实验学校高二化学平衡专题复习人教版【同步教育信息】一.本周教学内容:化学平衡专题复习二.重点、难点:1.化学平衡的特征2.化学平衡的移动及其与反应速率的关系三.具体内容:1.什么是化学平衡状态?化学平衡状态是指在一定条件下的可逆反应里:①正反应速率=逆反应速率,②反应混合物中各组分的含量保持不变的状态。2.化学平衡的特征①研究对象为可逆反应。②“等”:可逆反应达到平衡时,υ正=υ逆。第一层含义:用同种物质表示反应速率时,该物质的生成速率=消耗速率第二层含义:用不同物质表示反应速率时,某反应物的消耗(生成)速率:某生成物的消耗(生成)速率=化学计量数之比③“定”:平衡混合物中各组分含量(百分含量、物质的量、质量、浓度等)不随时间变化。④“动”:正逆反应同时进行,处于动态平衡。⑤“变”:一旦条件改变,正逆反应速率不再相等,平衡将发生移动,直至建立新的平衡。⑥“同”:化学平衡的建立与反应途径无关。对同一可逆反应,只要条件相同(温度、浓度、压强),不论从正反应、逆反应或正逆反应同时进行,均能达到同一平衡状态。例如:相同条件下,对于可逆反应2SO2+O22SO3,投料2molSO2和1molO2或投料2molSO3使反应进行,最终达到同一个平衡状态。3.判断化学平衡状态的标志(1)任何情况下均可作为标志的:①υ正=υ逆(同一种物质)②各组分含量(百分含量、物质的量、质量、物质的量浓度)不随时间变化③某反应物的消耗(生成)速率:某生成物的消耗(生成)速率=化学计量数之比④反应物转化率不变(2)在一定条件下可作为标志的是①对于有色物质参加或生成的可逆反应体系,颜色不再变化。②对于有气态物质参加或生成的可逆反应体系,若反应前后气体的物质的量变化不为0,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。③对于恒容绝热体系,体系的温度不再变化。(3)不能作为判断标志的是①各物质的物质的量或浓度变化或反应速率之比=化学计量数之比。(任何情况下均适用)②有气态物质参加或生成的反应,若反应前后气体的物质的量变化为0,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。[例1]下列方法中可以证明2HI(气)H2(气)+I2(气)已达平衡状态的是①单位时间内生成nmolH2的同时生成nmolHI②一个H-H键断裂的同时有两个H-I键断裂③百分组成HI%=I2%④反应速率υ(H2)=υ(I2)=0.5υ(HI)时⑤[HI]=[H2]=[I2]=2:1:1⑥温度和体积一定时,某一生成物浓度不再变化⑦温度和体积一定时,容器内压强不再变化⑧条件一定,混合气体的平均相对分子质量不再变化⑨温度和体积一定时混合气体的颜色不再变化⑩温度和压强一定时混合气体密度不再变化答案:②⑥⑨解析:①表示不同方向的反应,但生成H2与生成HI的物质的量之比应等于相应化学计量数之比②表示不同方向的反应且等于化学计量数之比,正确。③毫无根据,只在极特殊情况下成立④任何情况下均成立⑤平衡状态时浓度之比不一定等于化学计量数之比⑥浓度不变,说明已达平衡,正确⑦此反应前后气体体积不变,恒温恒容条件下任何时候容器内压强均不变⑧此反应前后气体物质的量不变,总质量不变条件下任何时候气体平均相对分子质量均不变⑨颜色不变说明浓度不变,正确⑩此反应前后气体物质的量不变,恒温恒压条件下体积不变,任何时候气体密度均不变二.影响化学平衡移动的条件1.什么是化学平衡移动2.运用图象理论分析:(1)其他条件不变,只改变浓度:移动原因增大[反应物]增大[生成物]减小[反应物]减小[生成物]υ正瞬时↑υ逆瞬时↑υ正瞬时↓≠0υ逆瞬时↓≠0速率变化υ逆从平衡点逐υ正从平衡点逐υ逆从平衡点逐υ正从平衡点逐渐↑渐↑渐↓渐↓υ,,,,,,正>υ逆υ逆>υ正υ逆>υ,正υ正>υ,逆移动方向正向逆向逆向正向最终υII>υIυII>υIυII<υIυII<υI(2)其他条件不变,只改变温度移动原因升温升温降温降温正反应热效应吸热放热吸热放热速率变化υ吸υ放同时↑υ吸υ放同时↑υ吸υ放同时↓υ吸υ放同时↓υ,,吸>υ放υ,,υ,,,吸>υ放吸<υ,放υ吸<υ放移动方向正向逆向逆向正向最终υII>υIυII>υIυII<υIυII<υI(3)其他条件...