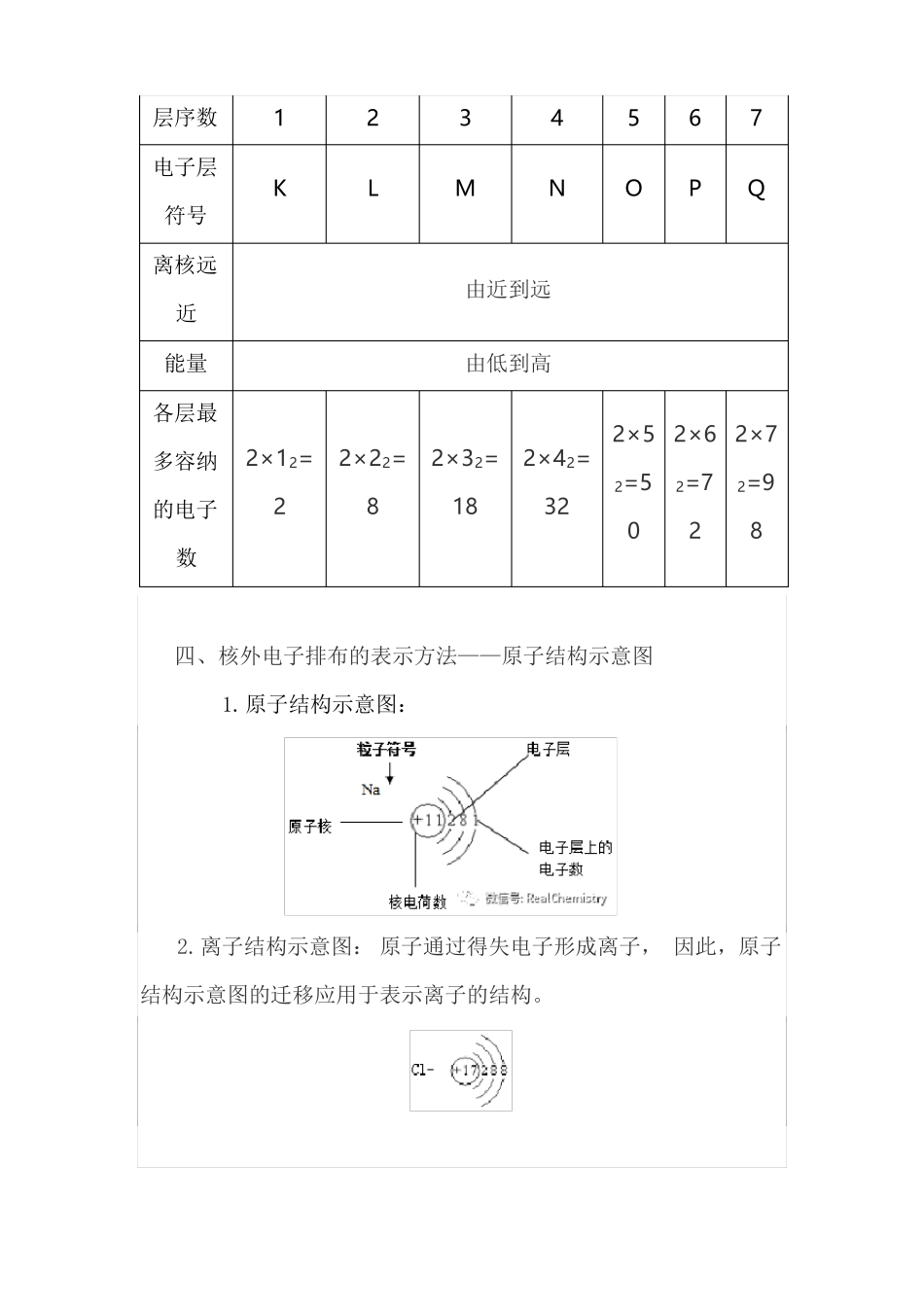
物质结构、元素周期律知识总结知识点一原子核外电子的排布一、电子层1.概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,也称作电子层。2.表示方法:通常吧能量最低、离核最近的电子层叫做第一层。能量稍高、离核稍远的电子层叫做第二层,由里往外以此类推。二、原子核外电子的排布规律(一低三不超)1.能量最低原理:原子核外电子总是尽可能优先排布在能量低的电子层里,然后由里向外,一次排布在能量逐步升高的电子层里,即电子最先排满K层,当K层排满后再排布在L层,依此类推。2.原子核外各电子层最多容纳2n2个电子(n为电子层序数)3.原子核外最外层电子不超过8个(K层作为最外层时,不超过2个)次外层电子不超过18个,倒数第三层电子不超过32个。三、原子核外各电子层的电子排布原子核外电子的排步层序数电子层符号离核远1K2L3M4N5O6P7Q由近到远近能量各层最多容纳的电子数四、核外电子排布的表示方法——原子结构示意图1.原子结构示意图:2×12=22×22=82×32=182×42=32由低到高2×52×62×72=52=72=90282.离子结构示意图:原子通过得失电子形成离子,因此,原子结构示意图的迁移应用于表示离子的结构。五、元素周期表中1-20号元素原子的结构特征1.最外层电子数和次外层电子数相等的原子有Be、Ar。2.最外层电子数和次外层电子数2倍的原子是C。3.最外层电子数和次外层电子数3倍的原子是O。4.最外层电子数和次外层电子数4倍的原子是Ne。5.次外层电子数是最外层电子数2倍的原子有Li、Si。6.内层电子总数是最外层电子数2倍的原子有Li、P。7.电子层数和最外层电子数相等的原子有H、Be、Al。8.电子层数是最外层电子数2倍的原子是Li、Ca。9.最外层电子数是电子层数2倍的原子有He、C、S。10.最外层电子数是电子层数3倍的原子是O。知识点二元素周期律元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性、最高价氧化物对应的水化物的酸碱性、气态氢化物的稳定性等)随着核电荷数的递增而呈周期性变化的规律。元素性质的周期性变化实质是元素原子核外电子排布的周期性变化的必然结果。元素周期律包括三个方面,一是核外电子排布,二是原子半径,三是元素主要化合价。一、.原子核外电子排布、化合价变化规律1.元素原子核外电子排布的周期性变化随着原子序数的递增,每隔一定数目的元素,元素原子的最外层电子数重复着从1到8(核外只有1个电子层时,最外层电子数最多为2),从不稳定结构到稳定结构的变化,所以随着原子序数的递增,元素原子的最外层电子的排布呈周期性变化。2.原子半径的周期性变化:随着原子序数的递增元素的原子半径重复出现从大到小的周期性变化(稀有气体除外)(1)随着原子序数的递增,同周期元素的原子半径逐渐减小。(2)随着原子序数的递增,同主族元素的原子半径依次增大。3.元素化合价的周期性变化随着原子序数的递增,元素的最高正化合价从最低+1到最高+7(H除外,F无正价,通常O也没有正价),再到稀有气体元素的0价呈周期性变化;元素的化合价从无(金属无负价)到有(非金属有负价),从最低(-4价)到最高(-1价),再到稀有气体元素的0价,也呈周期性变化。1-18号元素的原子核外电子排布、原子半径、主要化合价情况;元元原子序数1核外电电子排布子层数11最外原子相对最高化合层电半径原子数价素素符名子质最低化合量价号称H氢10.031.008+17He氦Li锂2322,11221--4.00300.156.941+12Be铍42,2220.089.012+29B硼52,3230.0810.81+32C碳62,4240.0712.01+4,-47N氮72,5250.0714.01+5,-35O氧82,6260.0716.00-24F氟92,7270.0719.00-11Ne氖102,828--20.180Na钠112,8,1310.1622.99+18Mg镁122,8,2320.1624.31+20Al铝132,8,3330.1426.98+33Si硅142,8,4340.1128.09+4,-47P磷152,8,5350.1130.97+5,-30S硫162,8,6360.1032.06+6,-22Cl氯172,8,7370.0935.45+7,-19Ar氩备注:182,8,838--39.950(1)具有2个电子的粒子有He、H2、H-、Li+、Be2+。(2)核外电子总数为10个电子的微粒共有15种。10电子微粒:一核:Ne、N3-、O2-、F-、Na+、Mg2+、Al3+二核:HF、OH-...