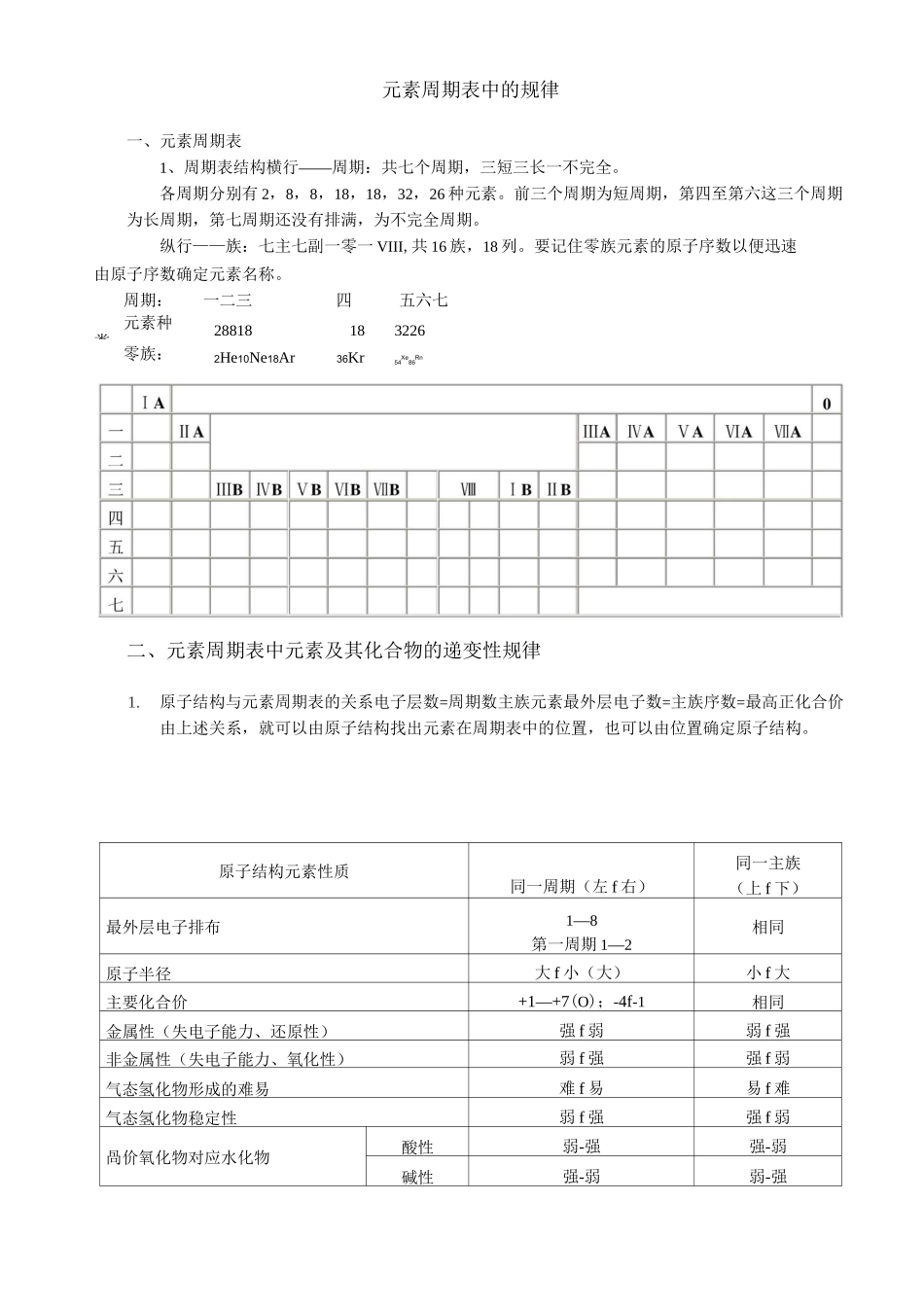
元素周期表中的规律一、元素周期表1、周期表结构横行——周期:共七个周期,三短三长一不完全。各周期分别有2,8,8,18,18,32,26种元素。前三个周期为短周期,第四至第六这三个周期为长周期,第七周期还没有排满,为不完全周期。纵行——族:七主七副一零一VIII,共16族,18列。要记住零族元素的原子序数以便迅速由原子序数确定元素名称。周期:一二三四五六七元素种类:28818183226零族:2He10Ne18Ar36Kr54Xe86Rn二、元素周期表中元素及其化合物的递变性规律1.原子结构与元素周期表的关系电子层数=周期数主族元素最外层电子数=主族序数=最高正化合价由上述关系,就可以由原子结构找出元素在周期表中的位置,也可以由位置确定原子结构。原子结构元素性质同一周期(左f右)同一主族(上f下)最外层电子排布1—8第一周期1—2相同原子半径大f小(大)小f大主要化合价+1—+7(O);-4f-1相同金属性(失电子能力、还原性)强f弱弱f强非金属性(失电子能力、氧化性)弱f强强f弱气态氢化物形成的难易难f易易f难气态氢化物稳定性弱f强强f弱咼价氧化物对应水化物酸性弱-强强-弱碱性强-弱弱-强非金厲性■笠隅性5由此可见,金属性最强的元素在周期表的左下角即Cs(Fr具有放射性,不考虑),非金属性最强的元素在右上角即F。对角线附近的元素不是典型的金属元素或典型的非金属元素。3、元素周期表中之最原子半径最小的原子:H原子质量最轻的元素:H元素;非金属性最强的元素:F金属性最强的元素:Cs(不考虑Fr)最高价氧化物对应水化物酸性最强的酸:HCIO4最高价氧化物对应水化物碱性最强的碱:CsOH形成化合物最多的元素:C元素所含元素种类最多的族:IIIB地壳中含量最高的元素:O元素,其次是Si元素地壳中含量最高的金属元素:Al元素,其次是Fe元素含H质量分数最高的气态氢化物:CH4与水反应最剧烈的金属元素:Cs元素与水反应最剧烈的非金属元素:F元素常温下为液态的非金属单质是Br2,金属单质是Hg4、特殊性在掌握原子结构、元素性质的一般规律时,还要注意特殊性:⑴原子最外层电子排布是1—8个电子,但第一周期是1—2个电子(2)同一周期原子半径由大T小,但稀有气体突然增大(严格讲,稀有气体中不是原子半径而是范德华半径)⑶同一周期元素主要化合价由+1价到+7价,但F没有+7价,O没有+6价。⑷原子核中通常含有质子和中子,但是;日原子中没有中子⑸碱金属是IA族,但不包括H元素,IA族包括H元素和碱金属5、半径大小规律1.原子半径:同主族——从上到下逐渐增大;同周期——从左到右逐渐减小(0族除外)2.离子半径:同主族——同价离子从上到下逐渐增大;同周期一一阴离子半径大于阳离子半径;具有相同的电子层结构的离子一一核电荷数越大,离子半径越小。3.同种元素的各种微粒,核外电子数越多,半径越大;反之,核外电子数越少,半径越小(如)。Fe〉Fe2+〉Fe3+元素周期表中的规律一、最外层电子数规律1.最外层电子数为1的元素:主族(IA族)、副族(IB、VIII族部分等)。2.最外层电子数为2的元素:主族(IIA族)、副族(IIB、IIIB、IVB、VIIB族)、0族(He)、VIII族(26Fe、27Co等)。3.最外层电子数在3~7之间的元素一定是主族元素。4.最外层电子数为8的元素:0族(He除外)。、数目规律1.元素种类最多的是第IIIB族(32种)。2.同周期第IIA族与第IIIA族元素的原子序数之差有以下三种情况:(1)第2、3周期(短周期)相差1;(2)第4、5周期相差11;(3)第6、7周期相差25。二设n澜朋序歎冉一阖黠E审氏盍的数园为:奇霰周閒为2:愠数阖期为2.如第了周需为2冲,第也周朋为2种…4.同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA~VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。三、化合价规律1.同周期元素主要化合价:最高正价由+1+7(稀有气体为0价)递变、最低负价由-4-1递变。2.关系式:(1)最高正化合价+|最低负化合价|=8;2)最高正化合价=主族族序数=最外层电子数=主族价电子数。3.除第VIII族元素外,原子序数为奇(偶)数的元素,元素所在族的序数及主要化合价也为奇(偶)数。四、...