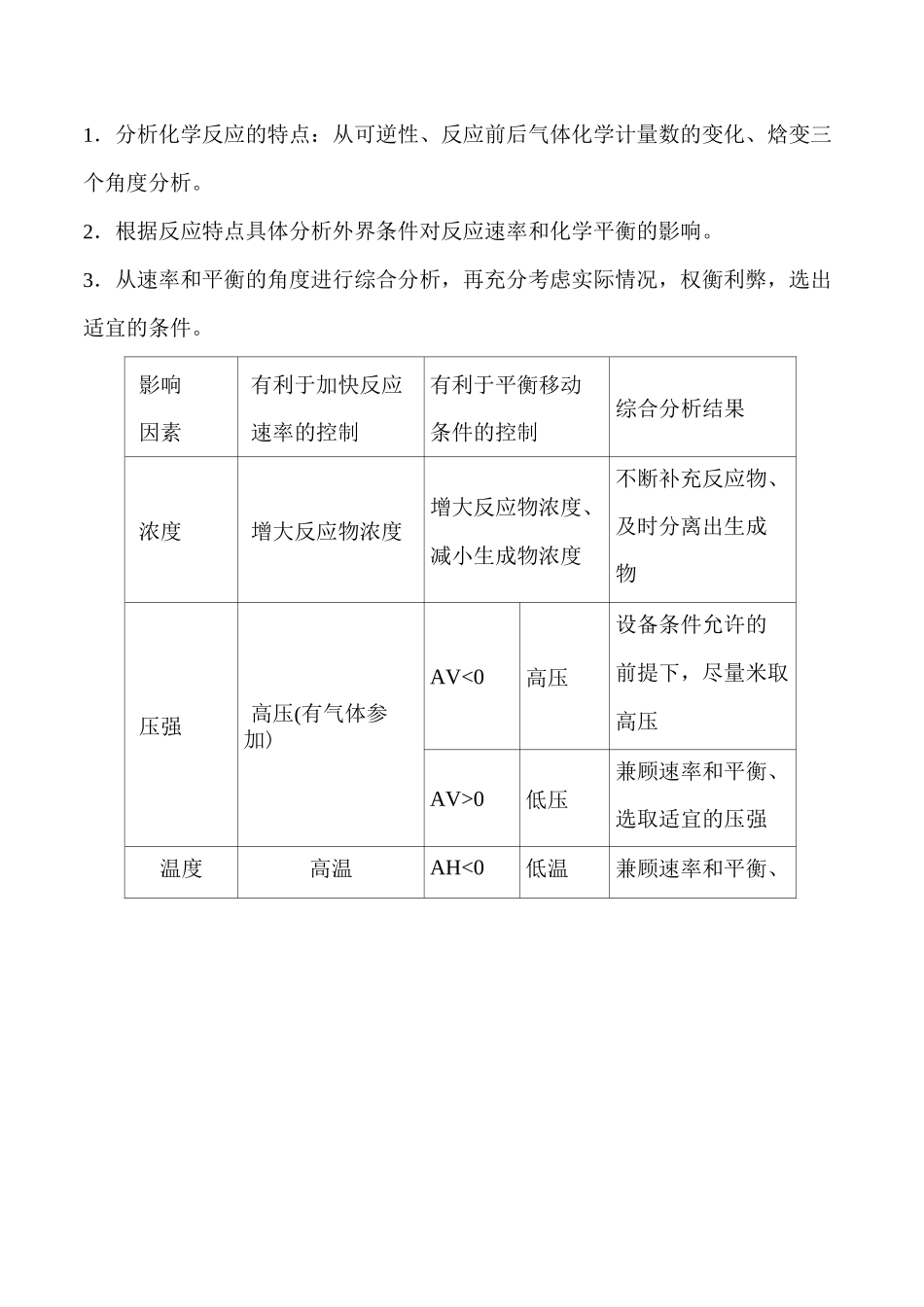
1•反应原理N2(g)+3H2(g)2•反应特点合成氨反应第4节化学反应的调控学案『新课程标准学业质量目标'1■认识化学反应速率和化学平衡的综合调控在生产、生活利科学研究中的重要作用。2”知道催化剂对以改变反应历程,对调控化学反应速率具有重要意义。11.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、生活、实验室中的实际问题,能讨论化学反应条件的选择和优化"(证据推理与模型认知)2.针对典型案例.能从限度、速率等角度对化学反应和化工生产条件进行综合分析。(科学态度与社会责任);必备知识•自主学习一、合成氨反应的特点;——2NHJg)AH=-92.4kJ・mol—1一可逆性;反应为可逆反应—体积变化:正反应是气体体积蜒的反应一恰变:A//<0,爛变:A5<0—自发性:常温下能口发进行(1)(前后串联)能加快合成氨反应的速率的方法有哪些?提示:增大压强、升高温度、增大反应物浓度、使用催化剂等,都能加快合成氨反应的速率。(2)(前后串联)能增大合成氨限度的方法有哪些?提示:增大压强、降低温度、增大反应物浓度等。二、合成氨条件的选择1•合成氨反应条件的选择原则工业生产中,必须从反应速率和反应限度两个角度选择合成氨的适宜条件。⑴尽量增大反应物的转化率,充分利用原料;(2)选择较快的化学反应速率,提高单位时间内的产量;(3)考虑设备的要求和技术条件。2.合成氨反应的适宜条件⑴压强①适宜条件:10MPa〜30MPa。②选择依据:压强越大,要求动力越大,对材料的强度和设备的制造要求就越⑵温度①适宜条件:400〜500°C左右。②选择依据:该温度下催化剂的活性最大,反应速率比较快,氨的含量也相对较高。⑶催化剂适宜条件:以铁为主体的多成分催化剂(又称铁触媒)。⑷浓度①适宜条件:N2和H2按物质的量之比1:2.8时混合,适时分离出氨气。②选择依据:适当提高生的浓度,来提高H2的转化率。⑸其他兼顾环境保护和社会效益,为了提高原料的利用率,未反应的N2和H2循环使用并及时补充N2和H2。主探索「判断下列说法是否正确(对的在括号内打叫”,错的在括号内打“x”。)(1)合成氨反应在高温下能自发进行。()提示:X。合成氨反应AHV0,AS<0,AH-TAS在高温大于0。(2)温度越高越利于合成氨反应平衡正向移动。()提示:X。合成氨反应AHV0,温度越低越利于平衡正向移动。(3)使用催化剂能提高合成氨反应物的平衡转化率。()提示:X。催化剂同倍数加快正、逆反应速率,对转化率无影响。关键能力•合作学习知识点…工业生产中适宜生产条件的选择思路1.分析化学反应的特点:从可逆性、反应前后气体化学计量数的变化、焓变三个角度分析。2.根据反应特点具体分析外界条件对反应速率和化学平衡的影响。3.从速率和平衡的角度进行综合分析,再充分考虑实际情况,权衡利弊,选出适宜的条件。影响因素有利于加快反应速率的控制有利于平衡移动条件的控制综合分析结果浓度增大反应物浓度增大反应物浓度、减小生成物浓度不断补充反应物、及时分离出生成物压强高压(有气体参加)AV<0高压设备条件允许的前提下,尽量米取高压AV>0低压兼顾速率和平衡、选取适宜的压强温度高温AH<0低温兼顾速率和平衡、C.考虑催化剂的适宜温度AH>0高温在设备条件允许的前提下,尽量米取高温并选取合适催化剂催化剂加合适的催化剂无影响加合适的催化剂,考虑催化剂活性与温度关系4合作探究在合成氨工业中要使用催化剂,既然催化剂对化学平衡的移动没有影响,为什么还要使用呢?催化剂铁触媒以什么形态存在更有利于反应进行?(变化观念与平衡思想)提示:为了加快反应速率。铁触媒是固体,粉末状更有利于反应进行。F典例示范:j【典例】(2021.烟台高二检测)下列关于工业合成氨的叙述正确的是()A.合成氨工业温度选择为700K左右,只要是为了提高NH3产率B•使用催化剂和施加高压,都能提高反应速率,但对化学平衡状态无影响合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率D.合成氨工业中为了提高氢气的利用率,可适当增加氢气浓度【思维建模】解析有关合成氨条件选择问题的思维流程如下:温度——升高温度利于化学反应速率,降低温度利于化学平衡移动;压强——增大压强利于化学反应速率和化学平衡移动;催化...