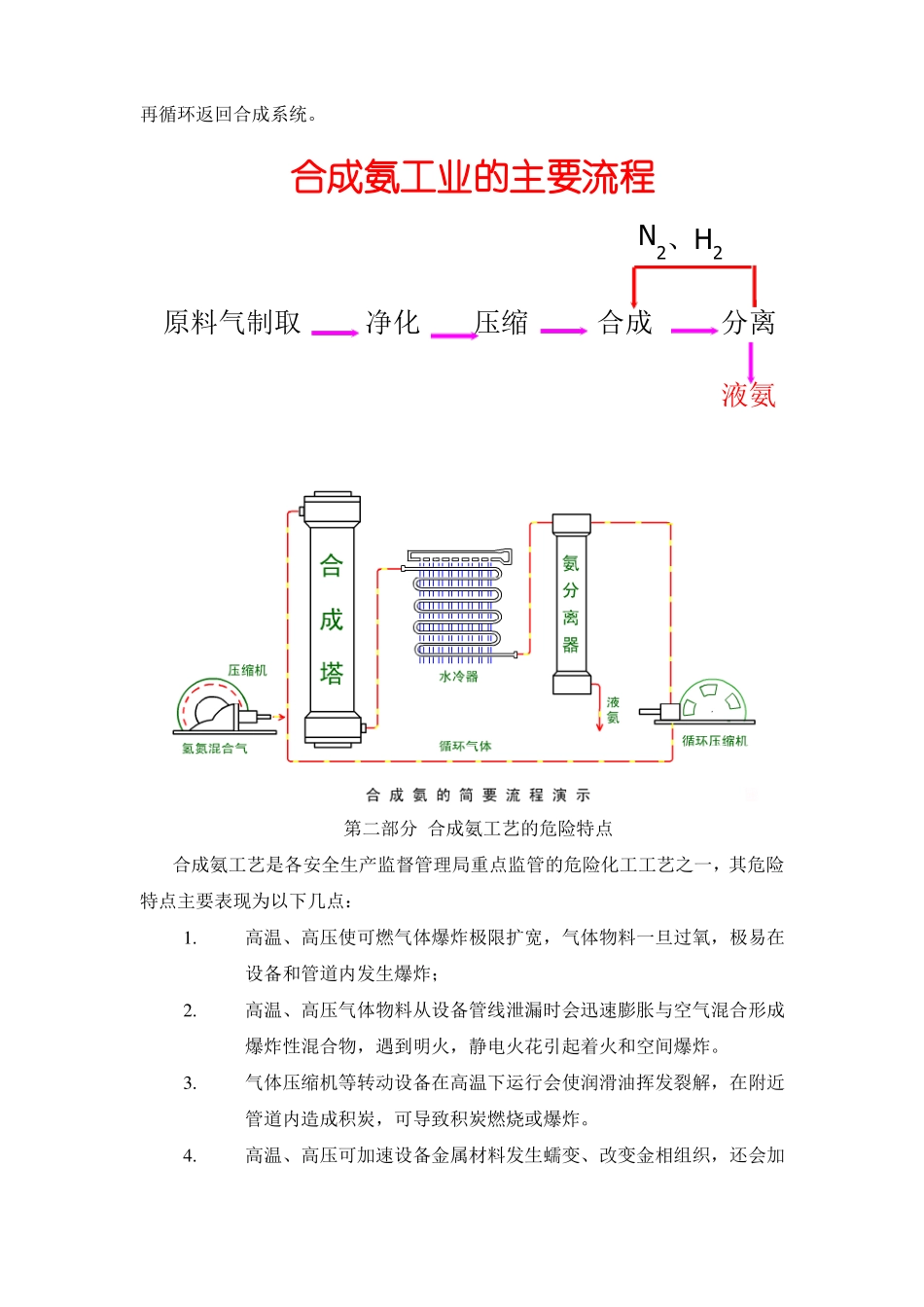
合成氨工艺作业第一部分合成氨概述第一节氨的生产简史世界上第一个研究成功合成氨技术的科学家是德国巴斯夫荷技术大学的哈伯教授,他在1901年开始研究氢与氮直接合成氨的研究,1908年在实验室研究取得成功。哈伯经研究发现:氨的合成转化率非常小,只有把高压的气体进行循环并将生成的氨在高压下除去,氨合成的技术方法是可行的。哈伯的这一著名的“循环法”专利一直被应用到现今的合成氨厂德国的巴斯夫(BASF)公司对哈伯的氨合成研究很感兴趣,购买了哈伯的专利,并授予布什伟氨合成工业化项目的负责人。哈伯完成了合成氨的基础研发工作,布什实现了合成氨的工业化。两人密切合作,1913年9月9日世界上第一座工业化的合成氨工厂在德国建成投产,氨厂的生产能力为30t/d。所以,合成氨工业的发展史迄今将近100年。第二节氨的性质和用途1.氨的物理性质氨为无色透明、有强烈刺激臭味的气体,能灼伤皮肤、眼睛、呼吸器官粘膜。氨的密度为0.771Kg/Nm3,液氨的比重0.667(20℃),液氨挥发性很强、气化热较大。氨极易溶于水,可生产含氨15~30%(重量)的商品氨水,氨溶解时放出大量的热。氨的水溶液呈弱碱性,易挥发。2.氨的化学性质液氨或干燥的氨气对大部分物质没有腐蚀性,但在有水的条件下,对铜、银、锌等金属有腐蚀作用。氨的自燃点630℃,在空气中燃烧分解为氮和水。氨与空气遇火能爆炸,在常压常温下氨的爆炸范围为15.5~28%,或13.5~82%(在氧气中)。氨是活泼性化合物,与酸作用生成盐类。例如,氨与硝酸作用生成硝酸铵,与二氧化碳作用生成氨基甲酸铵,然后脱水生成尿素。3.氨的用途(1)氨主要用于农业。除氨本身就可作为化肥外,几乎所有的氮肥、复合肥料都离不开氨。(2)氨不仅对发展农业有着重要的意义,而且也是重要的工业原料,广泛用于制药、炼油、合成纤维、合成树脂等工业部门。(3)将氨硝化可制成硝酸。硝酸用来制造氮肥,也是生产炸药、染料等产品的化工原料。(4)液氨是常用的冷冻剂。所以,氨是基本化工的产品之一,在国民经济中占有十分重要的地位。第三节合成氨生产的基本过程合成氨生产所用的原料,按物质状态可分为固体燃料、气体燃料和液体燃料。虽然生产原料不同,工艺流程也不相同,但基本上由四个部分组成,即原料气的制备、原料气的净化、压缩和合成、氨的分离。1.原料气的制备(简称造气)生产合成氨,首先必须制备含有氮和氢的原料气。它可以由分别制得的氢气和氮气混合而成,也可同时制得氢、氮混合气。氮气可取之于空气。将空气液化分离可制得氮气;或使空气通过燃料层燃烧,将生成的CO和CO2除去而制得氮气。氢气来源于水或含有烃类的各种原料。目前工业普遍采用以煤炭、天然气、重油等为原料,在高温下与水蒸气反应的方法来制取。2.原料气的净化除电解水外,不论采用何种原始原料和方法造气,原料气中都含有硫的化合物、一氧化碳、二氧化碳等对合成氨有害的各种杂质,必须采取适当的方法除去这些杂质,即对原料气进行净化,才能得到合格的氮氢原料气。3.压缩和合成将符合要求的氢、氮混合气压缩到一定压力,在高温和催化剂存在的条件下,合成为氨。4.氨的分离由于由氮气和氢气合成为氨的反应的转化率较低,故需在氨的合成工序之后通过氨的分离,以便将反应生成的氨分离出来,而未反应的原料气通过一个回路再循环返回合成系统。合成氨工业的主要流程N2、H2原料气制取净化压缩合成分离液氨第二部分合成氨工艺的危险特点合成氨工艺是各安全生产监督管理局重点监管的危险化工工艺之一,其危险特点主要表现为以下几点:1.高温、高压使可燃气体爆炸极限扩宽,气体物料一旦过氧,极易在设备和管道内发生爆炸;2.高温、高压气体物料从设备管线泄漏时会迅速膨胀与空气混合形成爆炸性混合物,遇到明火,静电火花引起着火和空间爆炸。3.气体压缩机等转动设备在高温下运行会使润滑油挥发裂解,在附近管道内造成积炭,可导致积炭燃烧或爆炸。4.高温、高压可加速设备金属材料发生蠕变、改变金相组织,还会加剧氢气、氮气对钢材的氢蚀及渗氮,加剧设备的疲劳腐蚀,使其机械强度减弱,引发物理爆炸。5.液氨大规模事故性泄漏会形成低温云团引起大范围人群中毒...