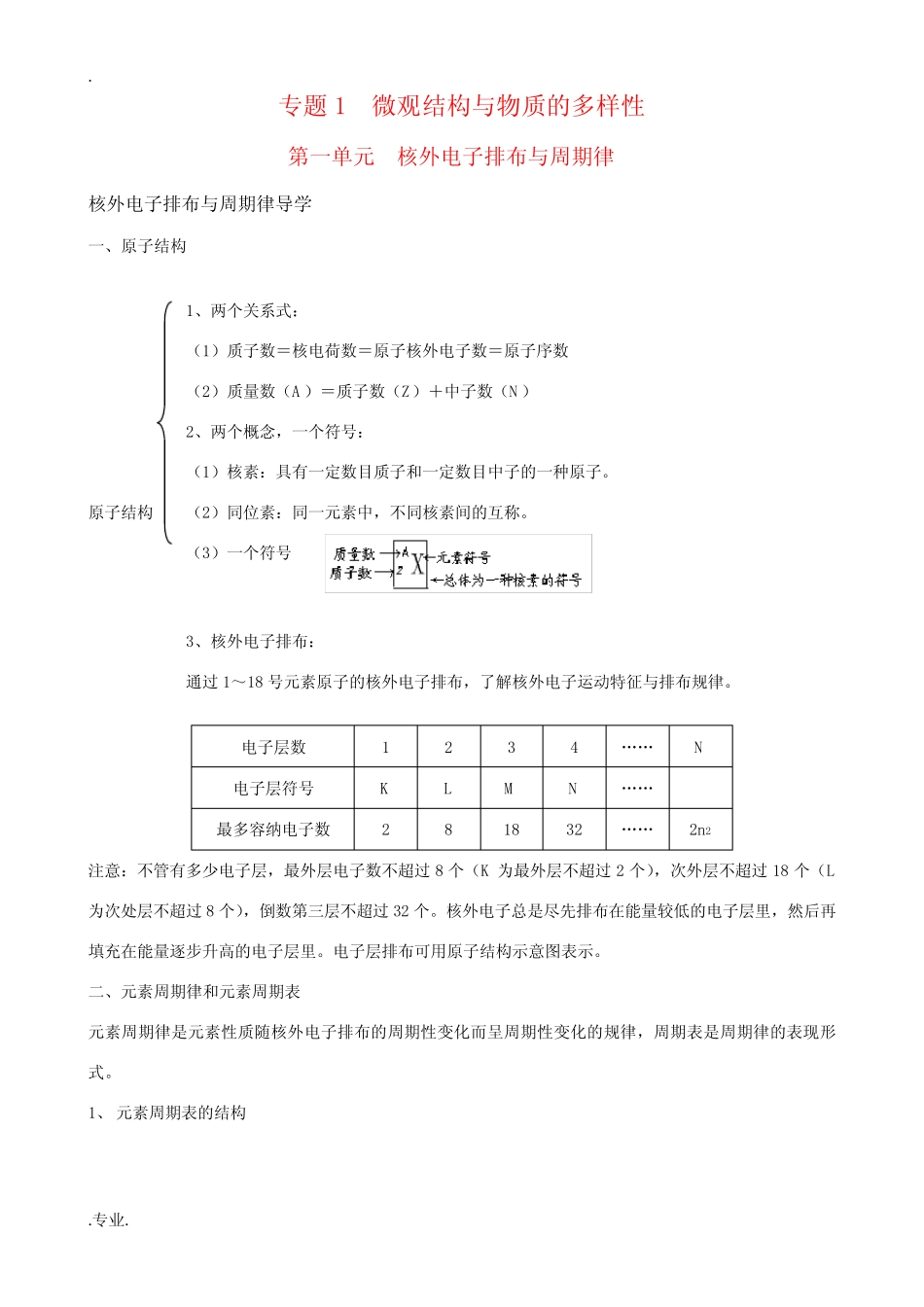
..专业.专题1微观结构与物质的多样性第一单元核外电子排布与周期律核外电子排布与周期律导学一、原子结构1、两个关系式:(1)质子数=核电荷数=原子核外电子数=原子序数(2)质量数(A)=质子数(Z)+中子数(N)2、两个概念,一个符号:(1)核素:具有一定数目质子和一定数目中子的一种原子。原子结构(2)同位素:同一元素中,不同核素间的互称。(3)一个符号3、核外电子排布:通过1~18号元素原子的核外电子排布,了解核外电子运动特征与排布规律。电子层数1234……N电子层符号KLMN……最多容纳电子数281832……2n2注意:不管有多少电子层,最外层电子数不超过8个(K为最外层不超过2个),次外层不超过18个(L为次处层不超过8个),倒数第三层不超过32个。核外电子总是尽先排布在能量较低的电子层里,然后再填充在能量逐步升高的电子层里。电子层排布可用原子结构示意图表示。二、元素周期律和元素周期表元素周期律是元素性质随核外电子排布的周期性变化而呈周期性变化的规律,周期表是周期律的表现形式。1、元素周期表的结构..专业.2、原子结构,元素性质及元素在周期表的位置关系(1)周期序数=原子电子层数(2)主族序数=最外层电子数=元素最高正价数(非金属元素最低负价数=主族序数-8)(3)同周期主族元素性质递变规律:①原子半径减小②金属性减弱,非金属性增强③最高正价数由+1递增到+7,负价由-4变化到-1④最高价氧化物对应水化物碱性增弱,酸性增强⑤非金属合成气态氢化物渐易,氢化物稳定性增强(4)同主族元素性质递变规律:①原子半径增大②金属性增强,非金属性减弱③最高价氧化物对应水化物碱性增强,酸性减弱④非金属合成气态氢化物渐难,氢化物稳定性减弱注意:电子层结构相同的微粒,核电荷数越多,半径越小。如:rCa2+