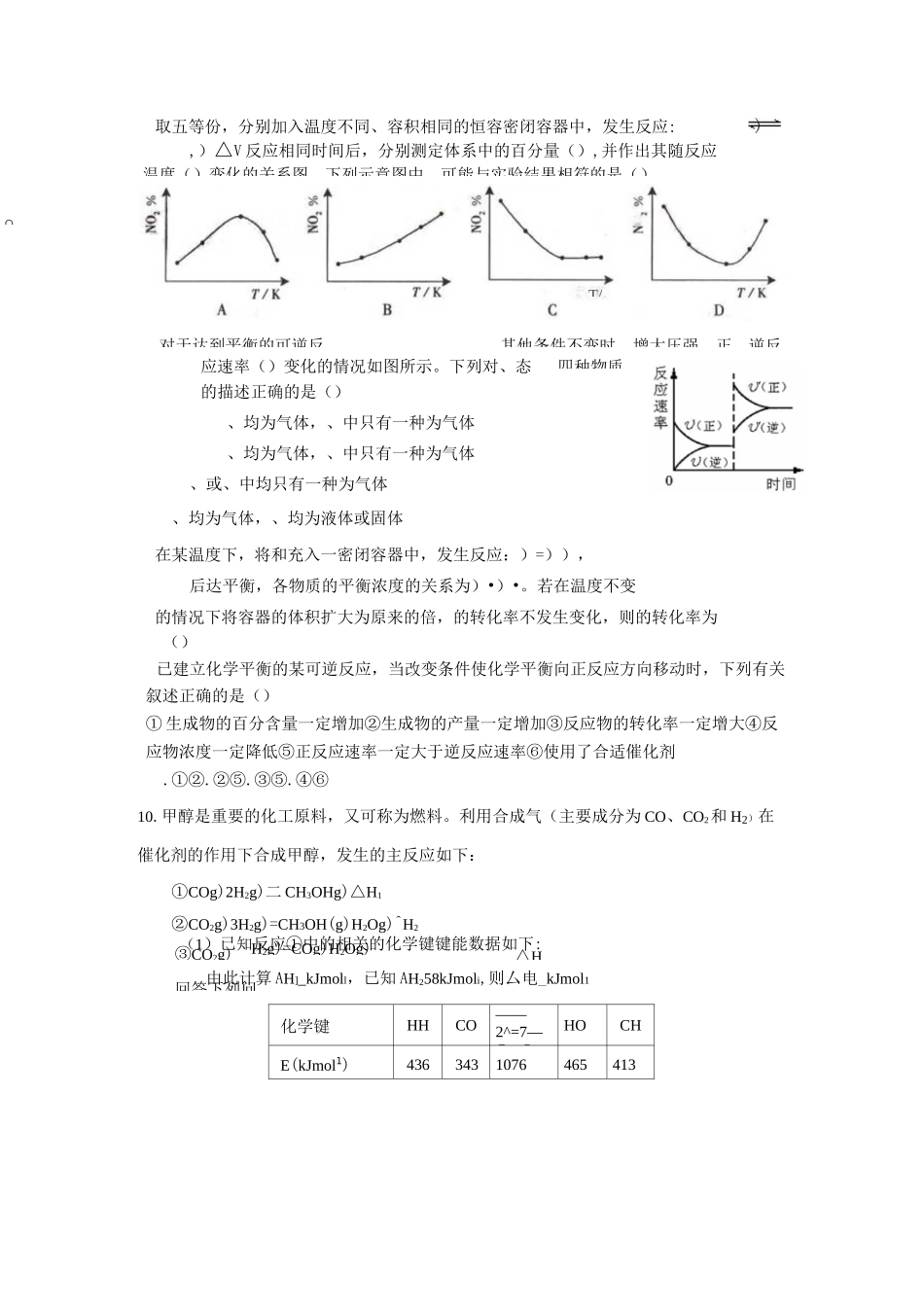
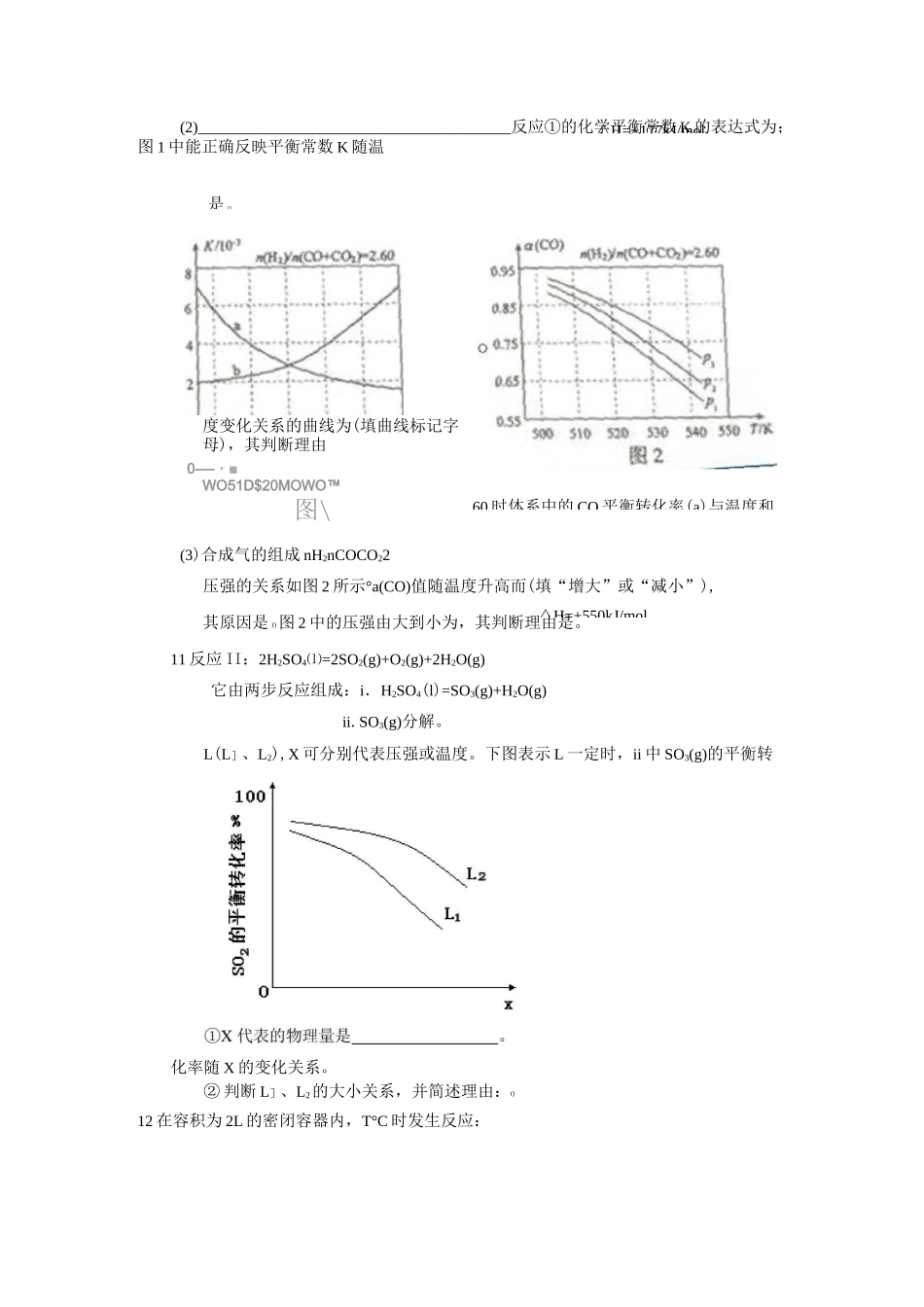
C反应前H2S物质的量为7molDCO的平衡转化率为80%汽车尾气中,产生的反应为:和在恒容密闭容器中反应,下图曲线曲线表示该反应在某一起始条件改变时=,一定条件下,等物质的量的表示该反应在温度下的浓度随时间的变化,的浓度随时间的变化。下列叙述正确温度下该反应的平衡常化学平衡练习一1某温度下,在2L的密闭容器中,加入lmolX(g)和2molY(g)发生反应:X(g)+mY(g)3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入lmolZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确.的是Am=2B两次平衡的平衡常数相同CX与Y的平衡转化率之比为1:1D第二次平衡时,Z的浓度为0.4mol・L-12黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g)AH=xkJ・mol-1已知硫的燃烧热山亍akJ・mo卜1S(s)+2K(s)==K2S(s)kJ.mol-1则x为()AH2=bkJ・mo卜12K(s)+N2(g)+3O2(g)==2KNO3(s)AH=c3羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)=COS(g)+H2(g)K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是A升高温度,H2S浓度增加,表明该反应是吸热反应B通入CO后,正反应速率逐渐增大温度下,随着反应的进行,混合气体的密度减小曲线对应的条件改变可能是加入了催化剂D若曲线b对应的条件改变是温度,可判断该反应的AHVO5已知H2(g)+l2(g)2HI(g);AH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各O.lmol,乙中加入HI0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是().甲、乙提高相同温度甲中加入,乙不改变.甲降低温度,乙不变甲增加,乙增加A.3a+b-cB.c+3a-bC.a+b-cD.c+a-b四种物质③CO2g)H2g)=COg)H2Og)回答下列问化学键HHCO——2^=7—C—OHOCHE(kJmol1)4363431076465413取五等份,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:,)△V反应相同时间后,分别测定体系中的百分量(),并作出其随反应应速率()变化的情况如图所示。下列对、态的描述正确的是()、均为气体,、中只有一种为气体、均为气体,、中只有一种为气体、或、中均只有一种为气体、均为气体,、均为液体或固体在某温度下,将和充入一密闭容器中,发生反应:)=)),后达平衡,各物质的平衡浓度的关系为)•)•。若在温度不变的情况下将容器的体积扩大为原来的倍,的转化率不发生变化,则的转化率为()已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是()①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂.①②.②⑤.③⑤.④⑥10.甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①COg)2H2g)二CH3OHg)△H1②CO2g)3H2g)=CH3OH(g)H2Og)^H2(1)已知反应①中的相关的化学键键能数据如下:由此计算AH]_kJmoll,已知AH258kJmoli,则厶电_kJmol1温度()变化的关系图。下列示意图中,可能与实验结果相符的是()OT/对于达到平衡的可逆反,其他条件不变时,增大压强,正、逆反△H△H=+550kJ/mol△H=+177kJ/mol(2)_________________________________________反应①的化学平衡常数K的表达式为;图1中能正确反映平衡常数K随温度变化关系的曲线为(填曲线标记字母),其判断理由0-—・■WO51D$20MOWO™图\(3)合成气的组成nH2nCOCO22压强的关系如图2所示°a(CO)值随温度升高而(填“增大”或“减小”),其原因是O图2中的压强由大到小为,其判断理由是。11反应II:2H2SO4⑴=2SO2(g)+O2(g)+2H2O(g)它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g)ii.SO3(g)分解。L(L]、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。②判断L]、L2的大小关系,并简述理由:O12在容积为2L的密闭容器内,T°C时发生反应:是O_60时体系中的CO平衡转化率(a)...