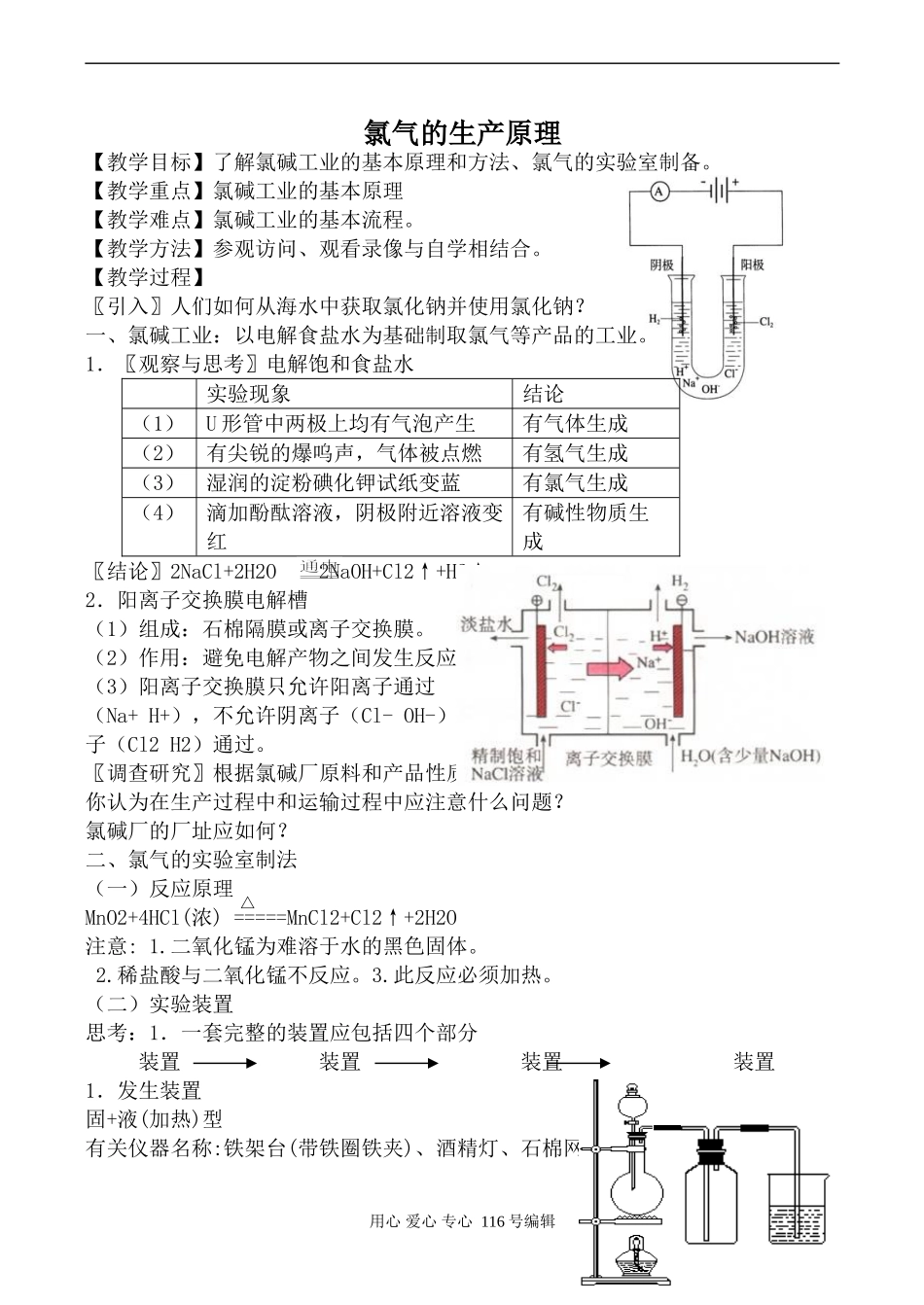
氯气的生产原理【教学目标】了解氯碱工业的基本原理和方法、氯气的实验室制备。【教学重点】氯碱工业的基本原理【教学难点】氯碱工业的基本流程。【教学方法】参观访问、观看录像与自学相结合。【教学过程】〖引入〗人们如何从海水中获取氯化钠并使用氯化钠?一、氯碱工业:以电解食盐水为基础制取氯气等产品的工业。1.〖观察与思考〗电解饱和食盐水实验现象结论(1)U形管中两极上均有气泡产生有气体生成(2)有尖锐的爆呜声,气体被点燃有氢气生成(3)湿润的淀粉碘化钾试纸变蓝有氯气生成(4)滴加酚酞溶液,阴极附近溶液变红有碱性物质生成〖结论〗2NaCl+2H2O2NaOH+Cl2↑+H2↑2.阳离子交换膜电解槽(1)组成:石棉隔膜或离子交换膜。(2)作用:避免电解产物之间发生反应。(3)阳离子交换膜只允许阳离子通过(Na+H+),不允许阴离子(Cl-OH-)和分子(Cl2H2)通过。〖调查研究〗根据氯碱厂原料和产品性质,你认为在生产过程中和运输过程中应注意什么问题?氯碱厂的厂址应如何?二、氯气的实验室制法(一)反应原理MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O注意:1.二氧化锰为难溶于水的黑色固体。2.稀盐酸与二氧化锰不反应。3.此反应必须加热。(二)实验装置思考:1.一套完整的装置应包括四个部分装置装置装置装置1.发生装置固+液(加热)型有关仪器名称:铁架台(带铁圈铁夹)、酒精灯、石棉网、用心爱心专心116号编辑△烧瓶、双孔塞、分液漏斗、玻璃导管。装配原则:自下而上思考:1.本实验装置有何不足?2.制取氯气的过程中可能产生哪些杂质气体,如何除去?2.净化装置3.气体收集和尾气处理装置1.氯气比空气重且能溶于水,应用什么方法收集?2.氯气有毒,不能排放到空气中,应如何处理?实验室制备氯气的装置图思考:仪器的装配原则?。(三)氯气的检验:氯气可用湿润的淀粉-碘化钾试纸放在集气瓶口检验,如试纸变蓝则表明已收集满。2KI+Cl2=2KCl+I2(碘遇淀粉变蓝)【思考】1.下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是A.CuCl2B.FeCl2C.FeCl3D.AlCl32.已知硫氰(SCN)2、氰气(CN)2和Cl2性质相似。试完成下列反应:①(CN)2+NaOH②MnO2+HSCN3.下图是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的装置图,根据图中装置和有关试剂回答下列各问题。用心爱心专心116号编辑△(1)指出上述图中的各处错误①②③④(2)在改正后的装置中,洗气瓶中的饱和食盐水、浓硫酸及广口瓶的氢氧化钠溶液的作用是①饱和食盐水的作用②浓H2SO4的作用。③氢氧化钠的作用。【课后练习】1.实验室制下列各组气体,所用气体发生装置相同的是A.H2和CO2B.H2和O2C.Cl2和CO2D.Cl2和H22.能用来干燥Cl2的干燥剂是A.浓H2SO4B.苛性钠C.无水氯化钙D.生石灰3.浓盐酸和Ca(ClO)2能发生如下反应:Ca(ClO)2+4HCl(浓)====CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓盐酸反应制得Cl2中,可能含有的气体杂质是①CO2②HCl③H2O④O2A.①②③B.②③④C.②③D.②④4.自来水可以用氯气消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显药品变质问题的是A.AgNO3B.FeCl2C.Na2SO3D.AlCl35.用Cl2和石灰乳制取漂白粉的理由是A.Ca(ClO)2比HClO稳定B.Ca(ClO)2比HClO氧化性强C.CaCl2也有氧化性D.Ca(ClO)2比HClO漂白快6.用自来水配制AgNO3溶液会产生浑浊现象,原因是发生下列反应;用自来水配制的KI溶液,往往呈黄色,原因是发生了下列反应。用心爱心专心116号编辑