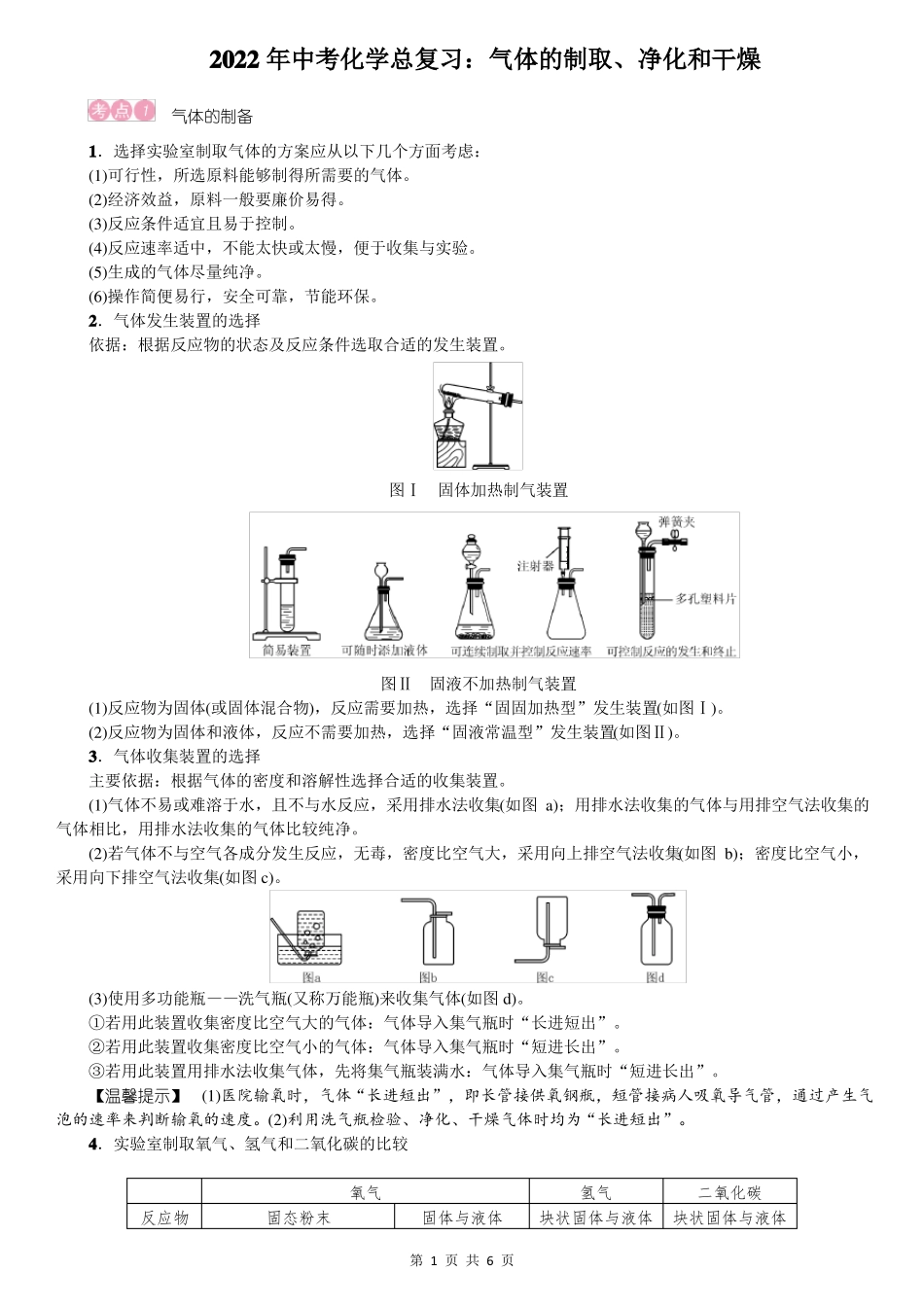
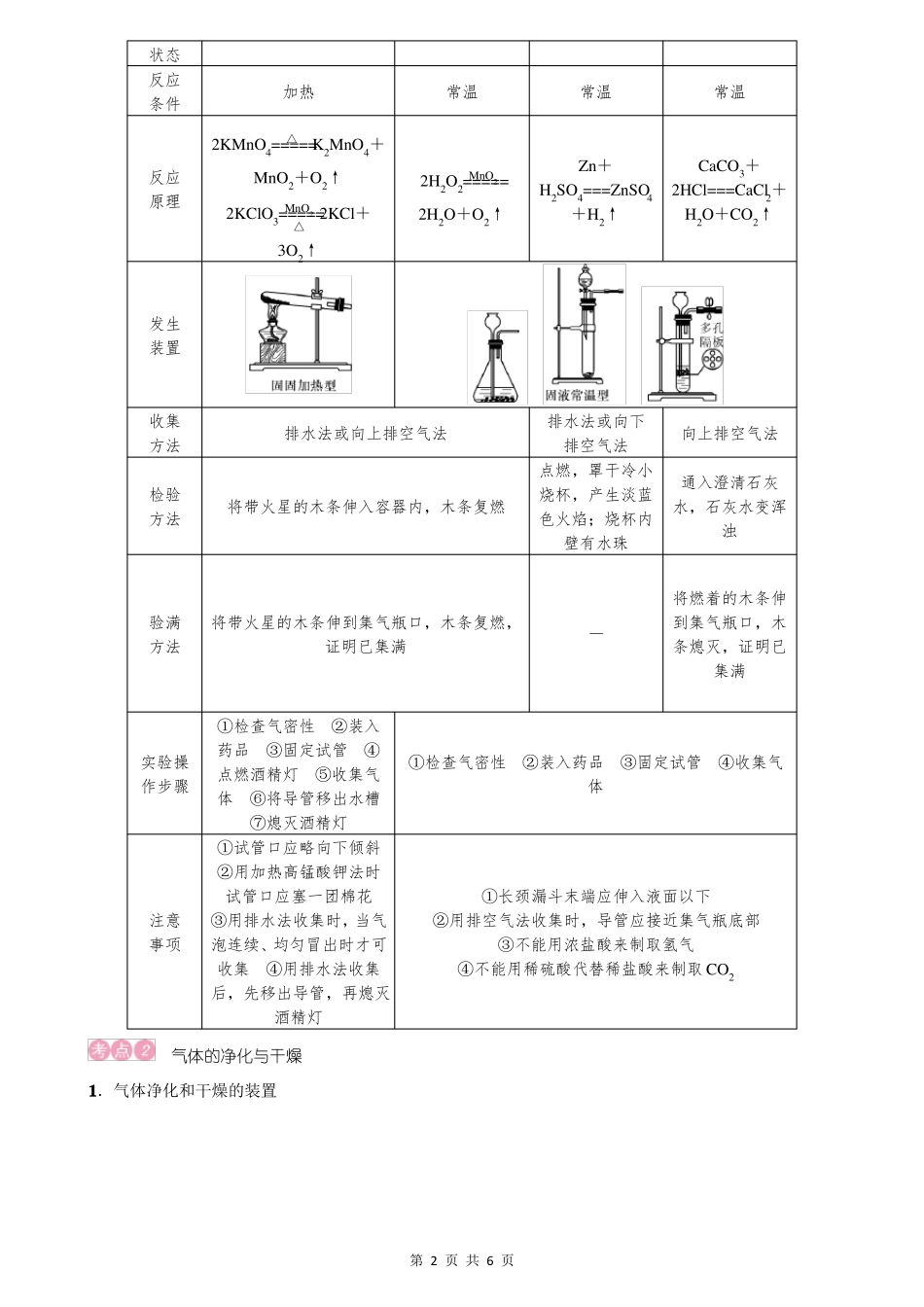
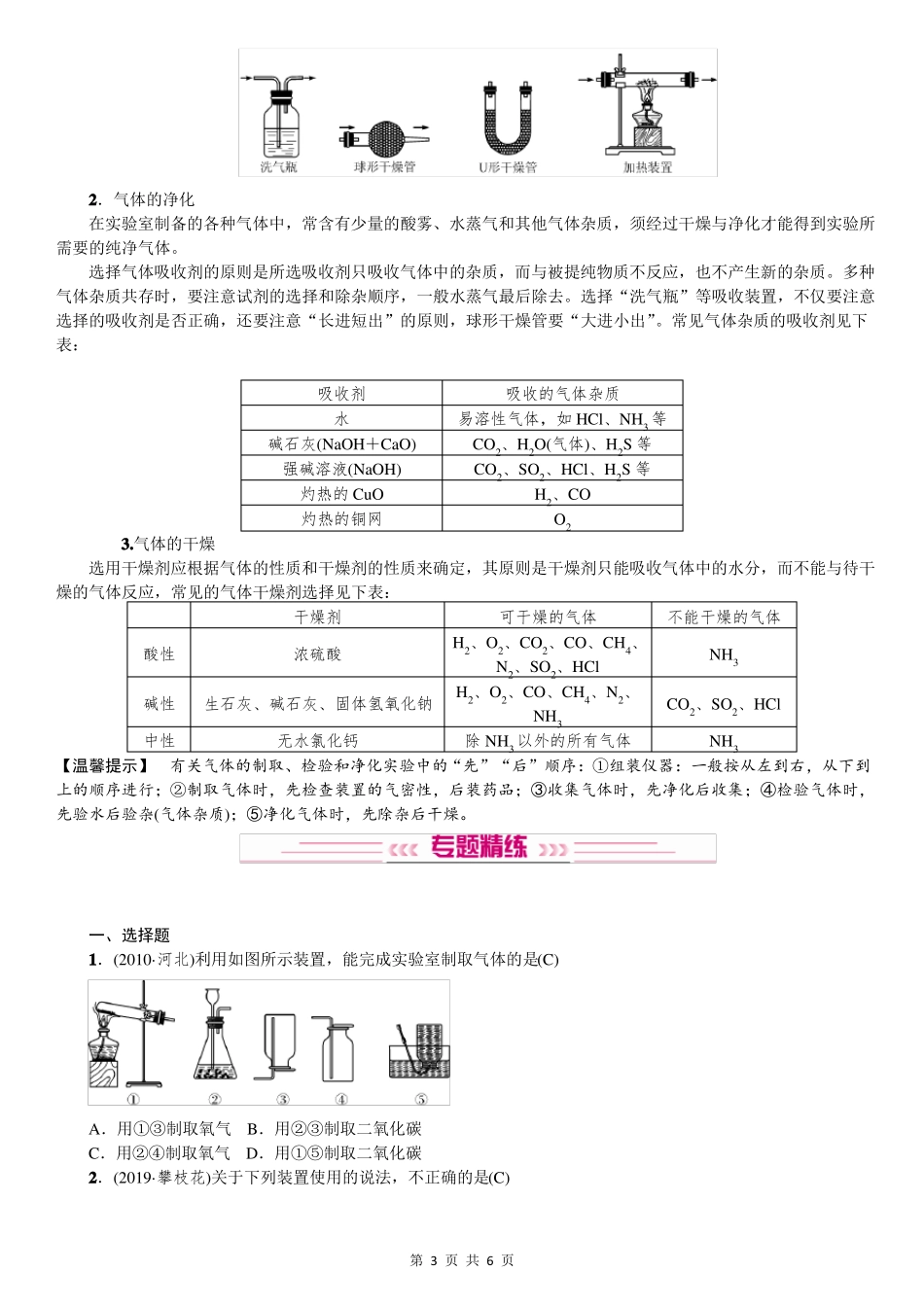
2022年中考化学总复习:气体的制取、净化和干燥气体的制备1.选择实验室制取气体的方案应从以下几个方面考虑:(1)可行性,所选原料能够制得所需要的气体。(2)经济效益,原料一般要廉价易得。(3)反应条件适宜且易于控制。(4)反应速率适中,不能太快或太慢,便于收集与实验。(5)生成的气体尽量纯净。(6)操作简便易行,安全可靠,节能环保。2.气体发生装置的选择依据:根据反应物的状态及反应条件选取合适的发生装置。图Ⅰ固体加热制气装置图Ⅱ固液不加热制气装置(1)反应物为固体(或固体混合物),反应需要加热,选择“固固加热型”发生装置(如图Ⅰ)。(2)反应物为固体和液体,反应不需要加热,选择“固液常温型”发生装置(如图Ⅱ)。3.气体收集装置的选择主要依据:根据气体的密度和溶解性选择合适的收集装置。(1)气体不易或难溶于水,且不与水反应,采用排水法收集(如图a);用排水法收集的气体与用排空气法收集的气体相比,用排水法收集的气体比较纯净。(2)若气体不与空气各成分发生反应,无毒,密度比空气大,采用向上排空气法收集(如图b);密度比空气小,采用向下排空气法收集(如图c)。(3)使用多功能瓶——洗气瓶(又称万能瓶)来收集气体(如图d)。①若用此装置收集密度比空气大的气体:气体导入集气瓶时“长进短出”。②若用此装置收集密度比空气小的气体:气体导入集气瓶时“短进长出”。③若用此装置用排水法收集气体,先将集气瓶装满水:气体导入集气瓶时“短进长出”。【温馨提示】(1)医院输氧时,气体“长进短出”,即长管接供氧钢瓶,短管接病人吸氧导气管,通过产生气泡的速率来判断输氧的速度。(2)利用洗气瓶检验、净化、干燥气体时均为“长进短出”。4.实验室制取氧气、氢气和二氧化碳的比较反应物氧气固态粉末固体与液体第1页共6页氢气二氧化碳块状固体与液体块状固体与液体状态反应条件加热2KMnO4=====K2MnO4+反应原理MnO2+O2↑2KClO3=====2KCl+△3O2↑MnO2△常温常温常温2H2O2=====2H2O+O2↑MnO2Zn+H2SO4===ZnSO4+H2↑CaCO3+2HCl===CaCl2+H2O+CO2↑发生装置收集方法检验方法排水法或向上排空气法排水法或向下排空气法点燃,罩干冷小烧杯,产生淡蓝色火焰;烧杯内壁有水珠向上排空气法通入澄清石灰水,石灰水变浑浊将带火星的木条伸入容器内,木条复燃验满方法将带火星的木条伸到集气瓶口,木条复燃,证明已集满—将燃着的木条伸到集气瓶口,木条熄灭,证明已集满实验操作步骤①检查气密性②装入药品③固定试管④点燃酒精灯⑤收集气体⑥将导管移出水槽⑦熄灭酒精灯①试管口应略向下倾斜②用加热高锰酸钾法时试管口应塞一团棉花③用排水法收集时,当气泡连续、均匀冒出时才可收集④用排水法收集后,先移出导管,再熄灭酒精灯①检查气密性②装入药品③固定试管④收集气体注意事项①长颈漏斗末端应伸入液面以下②用排空气法收集时,导管应接近集气瓶底部③不能用浓盐酸来制取氢气④不能用稀硫酸代替稀盐酸来制取CO2气体的净化与干燥1.气体净化和干燥的装置第2页共6页2.气体的净化在实验室制备的各种气体中,常含有少量的酸雾、水蒸气和其他气体杂质,须经过干燥与净化才能得到实验所需要的纯净气体。选择气体吸收剂的原则是所选吸收剂只吸收气体中的杂质,而与被提纯物质不反应,也不产生新的杂质。多种气体杂质共存时,要注意试剂的选择和除杂顺序,一般水蒸气最后除去。选择“洗气瓶”等吸收装置,不仅要注意选择的吸收剂是否正确,还要注意“长进短出”的原则,球形干燥管要“大进小出”。常见气体杂质的吸收剂见下表:吸收剂水碱石灰(NaOH+CaO)强碱溶液(NaOH)灼热的CuO灼热的铜网吸收的气体杂质易溶性气体,如HCl、NH3等CO2、H2O(气体)、H2S等CO2、SO2、HCl、H2S等H2、COO23.气体的干燥选用干燥剂应根据气体的性质和干燥剂的性质来确定,其原则是干燥剂只能吸收气体中的水分,而不能与待干燥的气体反应,常见的气体干燥剂选择见下表:酸性碱性中性干燥剂浓硫酸生石灰、碱石灰、固体氢氧化钠无水氯化钙可干燥的气体H2、O2、CO2、CO、CH4、N2、SO2、HClH2、O2、CO、CH4、N2、NH3除NH3以外的所有气体不能干燥的气体NH3CO2、SO2、HClNH3【温馨提示】有关气体的...