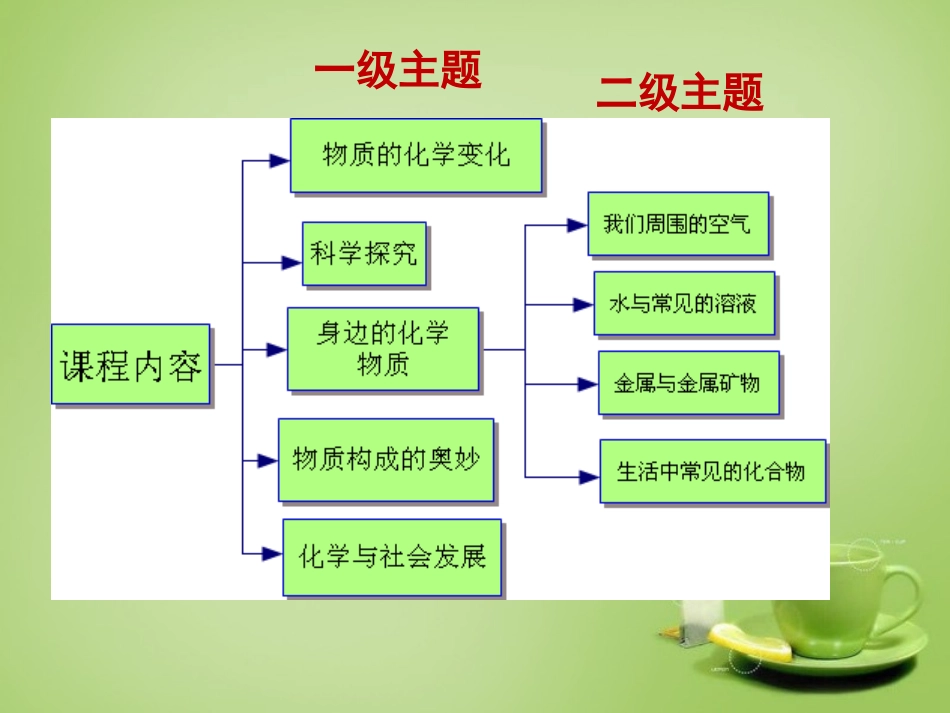
金属的化学性说课化学实验化学基本概念和原理化学计算初中化学元素化合物知识一级主题二级主题金属的化学性质是学生学完氧气和二氧化碳这两中单一物质的化学性质之后,将要学习的一类物质相似的化学性质.它们的相似之处在都要通过实验,观察实验现象,得出物质能和谁反应.不同之处在与之前是一种物质和几种物质之间的反应,现在是先通过一种物质与一类物质的反应然后推出一类物质和一类物质的反应。同时为后面学习酸、盐的化学性质,乃至高中化学原电池、金属的冶炼的学习起到了很好的铺垫作用。教材分析在学习氧气的化学性质时同学们已经知道了一些金属能和氧气反应,比如汞,镁。铁等。体会到了实验是学习物质化学性质的重要方法,初步学会如何观察实验现象。在学习二氧化碳的化学性质时,不仅体会到了实验的重要性,研究二氧化碳和水反应时,还学会了对比和控制变量的科学方法。这都为金属的学习打好了基础。本节内容除了对学生的上述方面能力的要求外,还要求学生有归纳总结实验现象的能力,还要有分类总结实验结论的能力。同时让学生感受到物质的共性和个性的并存的事实。学生不能把宏观的现象和微观的结构建立联系。学情分析金属的化学性质教学目标知识与技能过程与方法情感.态度.价值观1、初步认识常见金属与盐酸、稀硫酸以及盐溶液的置换反应。2、通过对金属活动性顺序的研究,能对有关的置换反应进行简单的判断,并能应用金属活动性顺序解释日常生活中的现象。3.从微观上解释金属化学性质存在的共性和差异的原因。通过对金属化学性质的实验探究过程,进一步激发学生对化学的学习兴趣,学生积极主动的用化学知识去解决生活中出现的一些实际问题1.初步学会运用化学基本观念——元素观、反应观、分类观及研究一类物质的方法。2.培养学生用宏观与微观、现象与本质、共性与个性的思维方法认识客观事物。3.通过比较、归纳等,让学生逐步掌握学习一类物质化学性质的一般方法。金属的化学性质教学目标教学重点教学难点归纳总结的能力、根据一定的实验目的设计实验的能力。体会结构和性质的关系通过复习回忆、活动探究归纳出金属活动性顺序,设疑导入激发激情问题导入实验验证从性质找结构发现个性温故旧知发现新知类比学习探究实验透过现象看本质从宏观到微观说设计联系生活学以致用设疑导入激发激情铁粉在空气中燃烧与铁丝在纯氧中燃烧形成矛盾冲突为后面的控制变量做铺垫温故旧知发现新知发现金属和氧气反应的难易程度及条件不同回忆课前引入的实验:意识到控制变量的重要性MgAlFeCu通过金属和氧气反应的难易程度及条件不同,得出常见金属的活动性金属与氧气的反应是金属活动性的第一个体现在4支试管里分别放入一小段铜丝、一个铁丝、少许锌粒,一小段镁条,再依次加入约占试管容积1/6的稀盐酸,仔细观察金属表面与溶液的变化。请记录实验现象。常见金属都能与酸(盐酸或稀硫酸)反应吗?不同的金属与酸反应的剧烈程度相同吗?问题导入实验验证问题导入实验验证Mg(无气泡生成)(H)CuFe反应的剧烈程度(单位时间放出氢气多少)控制相同条件酸金属同种类、同体积、同浓度形状、大小相近H+Cl-H+H+H+Cl-Cl-Cl-FeFeHHHHCl-Cl-Cl-Cl-Fe2+Fe2+H2金属与酸的反应的微观实质溶液中的水分子没有画出透过现象看本质从宏观到微观金属原子失电子变成金属离子氢离子得电子变成氢原子,氢原子在结合成氢分子Mg+2HCl=MgCl2+H2↑Mg+H2SO4=MgSO4+H2↑Zn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑单质单质单质单质化合物化合物化合物化合物++++置换反应温馨提示:铁和稀盐酸和稀硫酸反应时生成2价铁从相似的性质联想到相似的结构金属的最外层电子数一般小于4个易失电子类比学习探究实验早在2000多年前西汉时期就有“曾青得铁则化为铜”的记载。我国劳动人民早就认识了硫酸铜溶液里的铜能被铁置换出来,从而发明了湿法炼铜,揭开了湿法冶金术的序幕,成为人类冶炼史上的一个重要里程碑。给学生提供几种金属和几种盐溶液,任意组合探究反应的规律,类比金属与酸反应的方程式,试着写出金属与盐溶液的反应方程式总结规律:一种金属与另一种金属化合物溶液的反应的条...