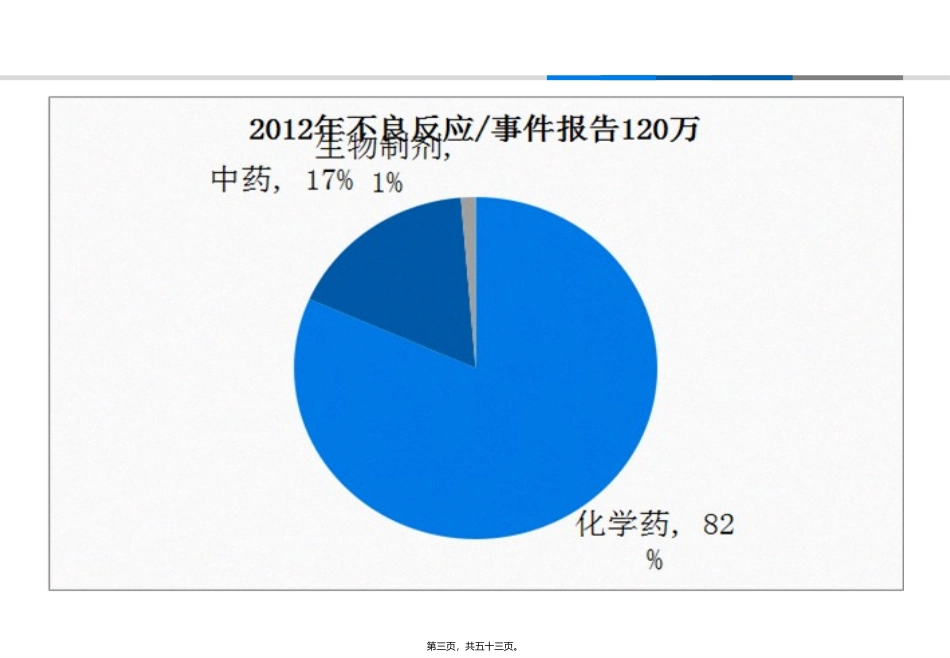
正确认识和应对药品不良反应第一页,共五十三页。PK第二页,共五十三页。第三页,共五十三页。2012年全国药品不良反应监测网络共收到14个大类中药注射剂报告10.3万例次,其中严重报告5500余例次,占5.3%。与2011年相比,中药注射剂报告数量同比增长58.2%,高于国家药品不良反应监测数据总体报告增长率;严重报告同比增长37.2%,低于总体严重报告增长率。2012年全国药品不良反应监测网络收到的严重报告中,中成药例次数排名前20位的均为中药注射剂。中药注射剂严重报告例次数排名前10位的品种依次为:清开灵注射剂、参麦注射剂、双黄连注射剂、血塞通注射剂、丹参注射剂、香丹注射剂、生脉注射剂、血栓通注射剂、脉络宁注射剂、黄芪注射剂。从药品不良反应/事件报告的患者用药情况看,中药注射剂与其他药品联合使用现象较为普遍,且有可能增加安全风险,提示临床使用中应谨慎联合用药,并加强对患者的不良反应监护。第四页,共五十三页。什么是药品不良反应?ADR(AdverseDrugReaction)ADE(AdverseDrugEvent)第五页,共五十三页。ADRAdverseDrugReaction在按规定剂量正常应用药品的过程中产生的有害而非所期望的、与药品应用有因果关系的反应。不良反应AdverseDrugEventADE世界卫生组织将不良事件也定义为不良感受,指药物治疗过程中发生的任何不幸的医疗事件,而这种事件不一定与药物治疗有因果关系。不良事件第六页,共五十三页。不良事件不良反应第七页,共五十三页。让我们回顾一下,历史上促使药品立法改革的著名不良反应事件。。。。。。第八页,共五十三页。“磺胺酏”事件酏剂:酒精含量一般在25%以下,味甜而香,供口服,在调配处方时作矫味剂。1935年格哈特•多马克磺胺的抑菌特性片剂胶囊剂1937年美国一家制药公司的主任药师瓦特金斯用二甘醇和水作溶媒,配制了一种色、香、味俱全的口服液体制剂——即磺胺酏剂。(但未做动物实验)磺胺酏剂应用后,造成了107人中毒死亡,300多人急性肾功能衰竭。试验证明,磺胺本身并无毒性,造成中毒死亡的是工业用的二甘醇。美国联邦法院以在酏剂中用二甘醇代替酒精,掺假及贴假标签为由,对该制药公司进行罚款,主任药师瓦特金斯也在内疚和绝望中自杀。该事件发生数月后,美国国会通过了《食品、药品和化妆品法》。从此,美国法规要求新药必须经过FDA的安全性检查,被批准后才可合法上市销售。第九页,共五十三页。“反应停”事件1953年瑞士诺华制药前身ciba药厂--沙利度胺联邦德国格仑南苏(ChemieGrünenthal)沙利度胺对中枢神经系统的作用显著抑制孕妇的妊娠反应1956年反应停(Thalidomide)正式投放市场被原联邦德国、澳大利亚、加拿大、日本拉丁美洲、非洲的28个国家广泛使用“没有任何副作用的抗妊娠反应药物”“孕妇的理想选择”1960年有医生发现欧洲新生儿畸形比率异常升高--“海豹”婴儿之后的毒理学研究显示沙利度胺对灵长类动物有很强的致畸性。1961年11月ChemieGrünenthal撤回联邦德国市场上所有反应停,不久其他国家也停止了反应停的销售。由于沙利度胺有万余名畸形胎儿出生。第十页,共五十三页。美国FDA官员在审查该药时,发现缺乏足够的临床试验数据而拒绝进口,从而避免了此次灾难。但由于私人从国外携药,美国造成9例畸形儿。美国国会随后对《食品药品和化妆品法》重大修改。第一次要求制药商在新药上市前向FDA提供临床实验证明的安全性和有效性的信息,并且要求制药商保留药品的不良反应记录。同时规定FDA有权力将已经上市销售的但被认为缺乏安全性的药品或缺乏有效性实质证据的药品从市场上取缔。“反应停”事件并未波及美国,但促成FDA修改法规第十一页,共五十三页。第十二页,共五十三页。2001年开始在中国上市2004年9月全球停止销售万络阿司咪唑片2004年2月13日批准说明书变更氯雷他定片国药准字H20070030息斯敏“不良反应”会导致某些药物退市第十三页,共五十三页。万艾可枸橼酸西地那非(SildenafilCitrate)2000年7月在中国上市用于治疗ED“不良反应”也会导致某些药物新适应症的开发第十四页,共五十三页。l阿司匹林(Aspirin)l诞生于1899l用于治感冒、发...