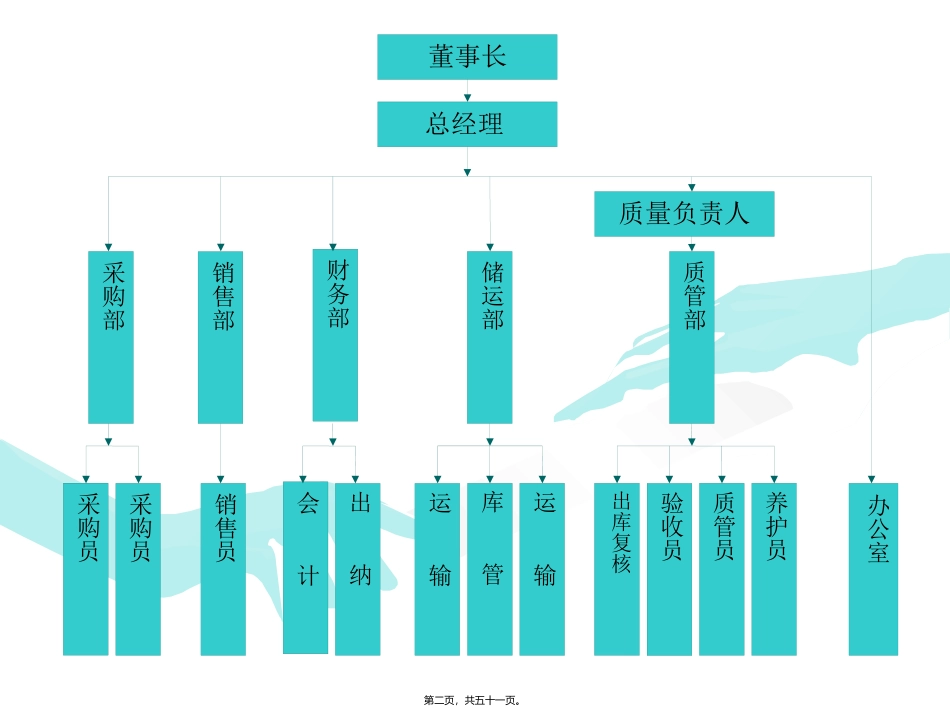
药品批发企业GSP认证检查评定标准(试行)(二)第一页,共五十一页。董事长总经理质量负责人采购部销售部质管部储运部财务部办公室采购员养护员质管员出库复核验收员库管销售员采购员会计出纳运输运输第二页,共五十一页。•质量记录:企业在质量体系运行的过程中,对所有质量运行活动和控制过程产生的行为和结果进行记载的证明文件。•我公司记录71种第三页,共五十一页。本公司的质量方针是:•“质量第一、诚信为本、优质服务、科学发展”•公司质量目标:•1、确保经营行为规范合法•2、确保经营药品安全有效•3、确保质量管理体系有效运行•4、最大限度满足客户需求•5、提高企业质量信誉及品牌效益第四页,共五十一页。*0801、企业制定的制度应包括:1、质量方针和目标管理;2、质量体系的审核;3、质量责任4、质量否决的规定;5、质量信息管理;6、首营企业和首营品种的审核;7、质量验收的管理;8、仓储保管、养护和出库复核管理;9、有关记录和凭证管理;10、特殊管理药品的管理;11、有效期药品、不合格药品和退货药品管理;12、质量事故、质量查询和质量投诉管理;13、药品不良反应报告的规定;14、卫生和人员健康状况管理;15、质量方面的教育、培训及考核的规定等内容。第五页,共五十一页。质量管理制度目录•1、质量方针目标管理制度•2、质量管理体系审核制度•3、质量否决制度•4、质量信息管理制度•5、首营企业和首营品种的审核制度•6、药品购进管理制度•7、药品质量验收管理制度•8、药品储存质量管理制度•9、药品养护管理制度•10、药品出库复核管理制度•11、药品销售及售后服务管理制度•12、药品运输管理制度•13、有关记录和凭证的管理制度•14、近效期药品管理制度第六页,共五十一页。质量管理制度目录•15、不合格药品管理制度•16、退货药品管理制度•17、进口药品管理制度•18、质量事故报告制度•19、质量查询管理制度•20、质量投诉管理制度•21、药品不良反应报告制度•22、用户访问管理制度•23、卫生和人员健康管理制度•24、设备的使用、维护和保养制度•25、计量器具管理制度•26、人员教育培训及考核制度•27、质量管理文件的管理制度•28、质量管理工作检查、考核及奖惩制度•29、直调药品管理制度第七页,共五十一页。*0802、企业应定期检查和考核质量管理制度执行情况,并有记录查:1.制度考核计划(至少半年一次)2.制度考核记录(包括考核部门、考核日期、考核人员、考核制度的名称、考核的内容存在的问题及改进措施、措施跟踪、考核工作总结、考核奖惩等)是否制定了考核计划是否是否有记录考核是否第八页,共五十一页。0901、企业应定期对《药品经营质量管理规范》实施情况进行内部评审。查:1.评审计划(在质量领导小组的组织下,至少每年一次)2.评审记录(应将管理职责、人员与培训、设施与设备、进货、验收、储存于养护、出库与运输、销售与售后服务等132项作为评审对象逐项全面评审)3.评审报告4.纠正措施是否制定了评审计划是否有无评审记录有无有无评审报告有无针对评审中存在问题有无纠正措施有无第九页,共五十一页。1001、企业主要负责人应具有专业技术职称,熟悉国家有关药品管理的法律、法规、规章和所经营药品的知识。•企业负责人具法人资格为法定代表人,不具法人资格为最高管理者。具有专业技术职称,熟悉国家有关药品管理法律法规。•GSP不规定企业负责人所学的专业,国家推行国家跨行业、跨地域组建集团化公司,投资者不一定为药学方面的人,这体现了药品的商品性;同时又体现药品的特殊性,即要求有专业技术职称,具备一定的基本文化素质,熟悉药品法律法规。第十页,共五十一页。*1101、企业质量管理工作的负责人的技术职称:大中型企业应具有主管药师或药学相关专业工程师以上的技术职称小型企业应具有药师药学相关专业助理工程师(含)以上的技术职称第十一页,共五十一页。*1201、企业质量管理机构的负责人应是执业药师或符合1101项的相应条件。大中型企业应具有主管药师或药学相关专业工程师以上的技术职称小型企业应具有药师药学相关专业助理工程师(含)以上的技术职称第十二页,共五十一页。1401、企业...