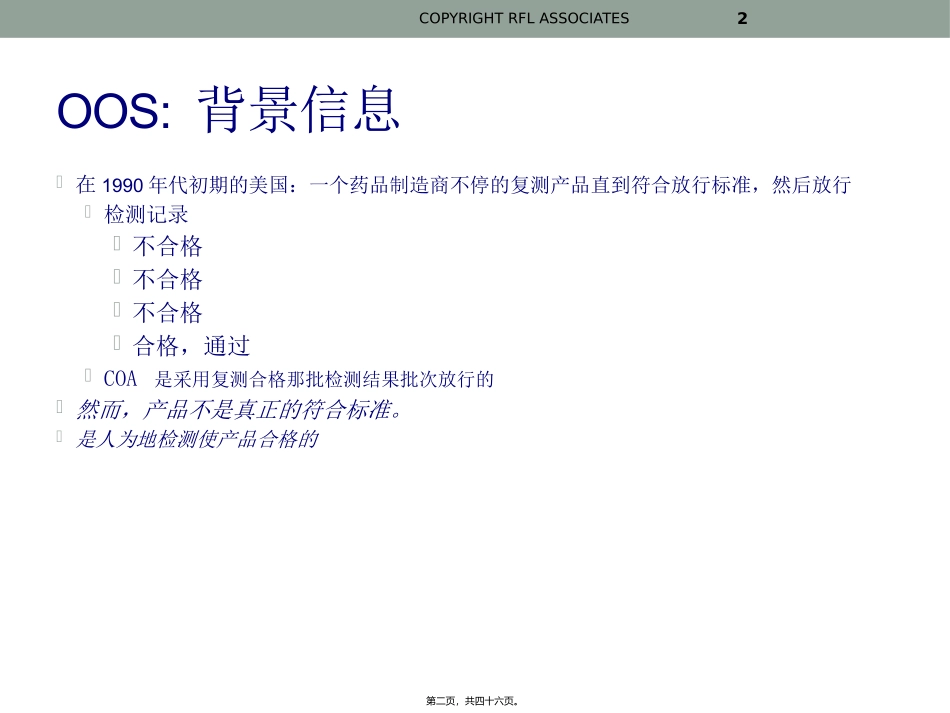
不合格(OOS)检测结果的调查药源药物化学2011年8月COPYRIGHTRFLASSOCIATES1第一页,共四十六页。OOS:背景信息在1990年代初期的美国:一个药品制造商不停的复测产品直到符合放行标准,然后放行检测记录不合格不合格不合格合格,通过COA是采用复测合格那批检测结果批次放行的然而,产品不是真正的符合标准。是人为地检测使产品合格的COPYRIGHTRFLASSOCIATES2第二页,共四十六页。OOS:背景信息•法院案例:USvs.BarrPharma(Barr决定)•结果,在1998年FDA发布了关于OOS的指南草案•最终指南在2006年10月发布。•http://www.fda.gov/cder/guidance/3634fnl.htmCOPYRIGHTRFLASSOCIATES3第三页,共四十六页。FDA指南文件•OOS是FDA的指南文件,不是要求•指南文件不同于:•FDA法律•FDA条例COPYRIGHTRFLASSOCIATES4第四页,共四十六页。FDA指南文件•指南代表了FDA的对一个主题的当前意见。•指南文件为开展这个讨论的主题,提供了一个GMP的模板•如果愿意,一个公司可以用不同的方法解决GMP的问题•但是,不同的方法必须遵循GMPs才是有效的•因此,最好还是密切遵循FDA的指南COPYRIGHTRFLASSOCIATES5第五页,共四十六页。OOS调查的目的•确保药品的生产和检测是遵循GMPs。•确保实验室的检测结果是有效的(科学合理的)•确定导致检测结果有问题的原因,是否是:•实验室(QC)的错误•生产的错误COPYRIGHTRFLASSOCIATES6第六页,共四十六页。OOS指南范围•覆盖了QC实验室检测的•活性药物成分(APIs)•赋形剂和成品剂型的其他组成成分。•中控物料•药品•不包括生物测定,如体内测定和免疫测定(为什么?)COPYRIGHTRFLASSOCIATES7第七页,共四十六页。FDAOOS指南范围•适用于所有实验室检测结果中超出规定标准的情况。•OOS原则也适用于OOT(超趋势)的检测结果•一个好的GMP对于关键数据(如检测数据)进行趋势分析,建立OOT的限度。•指南论述:•如何进行OOS的结果调查•实验室人员的职责•实验室的阶段调查•额外检测(什么时候停止)•调查扩展到实验室外•最终结果的评估COPYRIGHTRFLASSOCIATES8第八页,共四十六页。对于OOS调查的评论•在现场检查,检察官、化学家会要求审查:•公司的OOSSOP文件•请将这重要的SOP翻译成英文。•应包括一个涵盖OOS调查各阶段的流程图•关于进行的OOS调查的汇总•多少?是哪些产品或组分?•发生OOS结果占检测总数的百分比?•扩展到实验室外调查的OOS有多少?(i.e.不是实验室的错误)•OOS调查报告的例子:原料,APIs,药物成品等。•检察官需要对OOS是否正确开展调查做一个判断。COPYRIGHTRFLASSOCIATES9第九页,共四十六页。对于OOS调查的评论(继续)•我强烈建议也对OOT做调查。•这表明对品质的高度承诺。•如果只有少量的OOS,OOT调查能表明程序正在正确的执行。COPYRIGHTRFLASSOCIATES10第十页,共四十六页。重要性•确保化学师、分析员经过良好的OOS程序的培训,他们将失败的结果报告给经理。•如果分析人员不去报告OOS结果,将使OOS程序的目的无法达到•化学师、分析员与负责人、经理之间需要建立信任COPYRIGHTRFLASSOCIATES11第十一页,共四十六页。OOS调查的三个阶段•第一阶段:实验室的调查•确定是否是实验室的错误•同时涉及分析员和实验室负责人•如果发现实验室错误,调查可能会结束。•如果不是实验室的错误,将扩展到第二阶段的调查。COPYRIGHTRFLASSOCIATES12第十二页,共四十六页。OOS调查阶段•第二阶段:全面的OOS调查•质量部门(QA)将正式参与•审核批生产记录•可能会复测或重新取样,但只能在一个确定好的方案或计划的情况下进行•第三阶段:调查结论COPYRIGHTRFLASSOCIATES13第十三页,共四十六页。阶段I:实验室错误?是或否•目的:确定检测结果是否:•清楚显现实验室错误(检测结果无效)•称重•稀释•污染•其他或•显然是有效的检测结果,因此是生产的错误•但是,有时没有明确的结论。。。COPYRIGHTRFLASSOCIATES14第十四页,共四十六页。阶段I:实验室的调查关于OOS的小测试:1.在得到不合格检测结果之后,一个样品能复测多少次?2.化学师/分析员没有通知管理层能否决定重新进样HPLC分析...