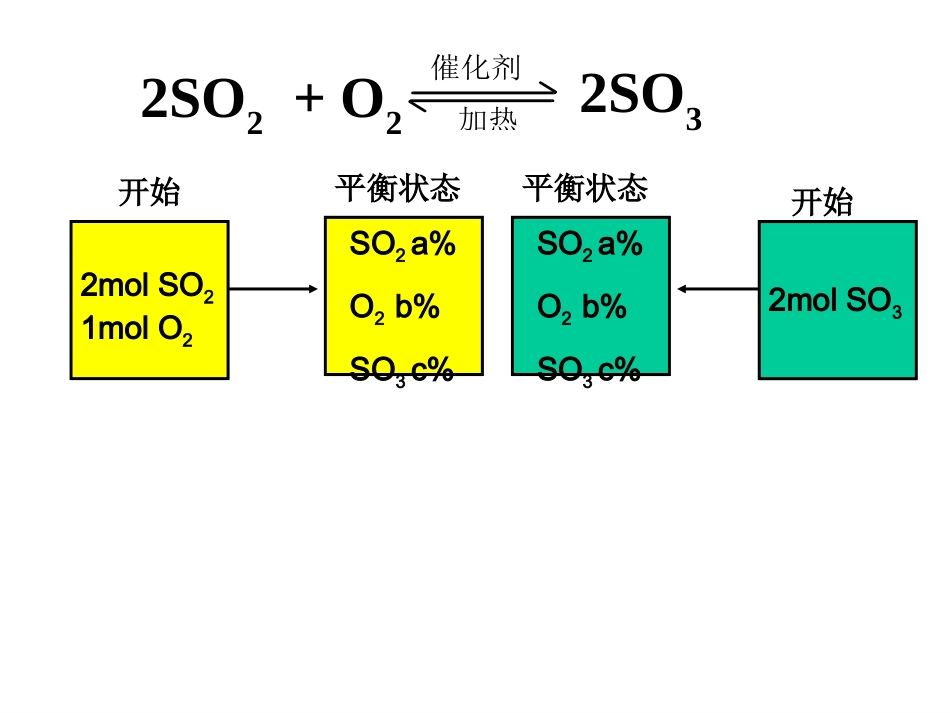
化学平衡关于等效平衡的初步概念一、化学平衡状态:1、一定条件下2、可逆反应3、正反应速率等于逆反应速率4、各组分的浓度保持不变二、化学平衡状态建立的途径:1、先加入反应物,从正反应方向开始。2、先加入生成物,从逆反应方向开始。2molSO21molO2开始2molSO3开始SO2a%O2b%SO3c%平衡状态2SO2+O2催化剂加热2SO3SO2a%O2b%SO3c%平衡状态2molSO21molO2开始2molSO3开始SO2a%O2b%SO3c%平衡状态1molSO20.5molO21molSO3?2SO2+O2催化剂加热2SO32molSO21molO2开始SO2a%O2b%SO3c%平衡状态SO2a%O2b%SO3c%平衡状态2molSO3开始SO2a%O2b%SO3c%平衡状态相当于开始加入1molSO2、0.5molO2和1molSO32SO2+O2催化剂加热2SO32molSO21molO2开始SO2a%O2b%SO3c%平衡状态SO2a%O2b%SO3c%平衡状态2molSO3开始SO2a%O2b%SO3c%平衡状态相当于开始加入0.5molSO2、0.25molO2和1.5molSO32SO2+O2催化剂加热2SO32molSO21molO2开始SO2a%O2b%SO3c%平衡状态SO2a%O2b%SO3c%平衡状态2molSO3开始SO2a%O2b%SO3c%平衡状态相当于开始加入0.25molSO2、0.125molO2和1.75molSO32SO2+O2催化剂加热2SO3三、建立等效平衡的途径:1、先加入反应物,从正反应方向开始,可以建立化学平衡。2、若先加入生成物,从逆反应方向开始,也可以建立等效的化学平衡。3、若同时加入反应物与生成物,从中间状态开始,同样可以建立等效的化学平衡。例1、在一定的温度下,把2molSO2和1molO2通入一定容积的密闭容器里,发生如下反应:2SO2+O22SO3当此反应进行到一定的程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2、和SO3的物质的量(mol)。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:(1)若a=0、b=0,则c=,(2)若a=0.5,则b=,c=,(3)a、b、c取值必须满足一般的条件是(用两个方程式表示,其中一个只含a和c,另一个只含b和c),。催化剂加热20.251.5a+c=2b+c/2=12SO2(g)+O2(g)2SO3(g)起始(mol):aSO2,bO2,cSO32SO2(g)+O2(g)2SO3(g)abc0b+c/2a+c21210等效平衡的判断对于同一可逆反应,在一定条件下,对于同一可逆反应,在一定条件下,以不同投料方式进行反应,只要达到以不同投料方式进行反应,只要达到平衡时平衡时相同组分在各混合物中的百分相同组分在各混合物中的百分数数(体积、物质的量或质量分数)(体积、物质的量或质量分数)相相等等,这样的化学平衡即互称为,这样的化学平衡即互称为等效平等效平衡衡。。组分的百分数相同,包括体积分数、物质的量分数或质量百分数,而不一定是指浓度相同,因为同一组分百分数相同时其浓度不一定相等。2SO2+O2催化剂加热2SO32molSO21molO2开始SO2a%O2b%SO3c%平衡状态讨论1(恒温恒容)A.2molSO3B.4molSO2+2molO2(210)(420)规律Ⅰ:对于反应前后气体分子数有变化的可逆反应2molSO21molO2恒温恒容4molSO22molO22molSO21molO22SO2+O2催化剂加热2SO32molSO21molO2开始SO2a%O2b%SO3c%平衡状态2SO2+O2催化剂加热2SO32molSO21molO2开始SO2a%O2b%SO3c%平衡状态讨论1(恒温恒容)D.1molSO2+0.5molO2+1molSO3(A、D)A.2molSO3B.4molSO2+2molO2C.2molSO2+1molO2+2molSO3(210)(420)(420)(210)•此例计算的关键是换算到同一边后各组分要完全相同。2SO2+O2催化剂加热2SO32molSO21molO2开始SO2a%O2b%SO3c%平衡状态讨论2(恒温恒压)A.2molSO3B.4molSO2+2molO2C.2molSO2+1molO2+2molSO3D.1molSO2+0.5molO2+1molSO3(210)(420)(420)(210)4molSO22molO22molSO21molO22molSO21molO22molSO21molO2开始恒温恒压SO2a%O2b%SO3c%平衡状态SO2a%O2b%SO3c%对于反应前后气体分子数有变化的可逆反应:恒温恒容——(进行等效转化后)投料量与原平衡起始量对应物质完全相同,则两平衡等效。恒温恒压——(进行等效转化后)投料量与原平衡起始量对应物质成比例,则两平衡等效。规律Ⅰ:练习1A、B两容器,A容器容积固定,B容器容积可变。一定温度下,在A中加入2molN2和3molH2,当N2(g)+3H2(g)2NH3(g)反应达平衡时,生成的NH3的物质的量为m。相同温度下,保持B的容...