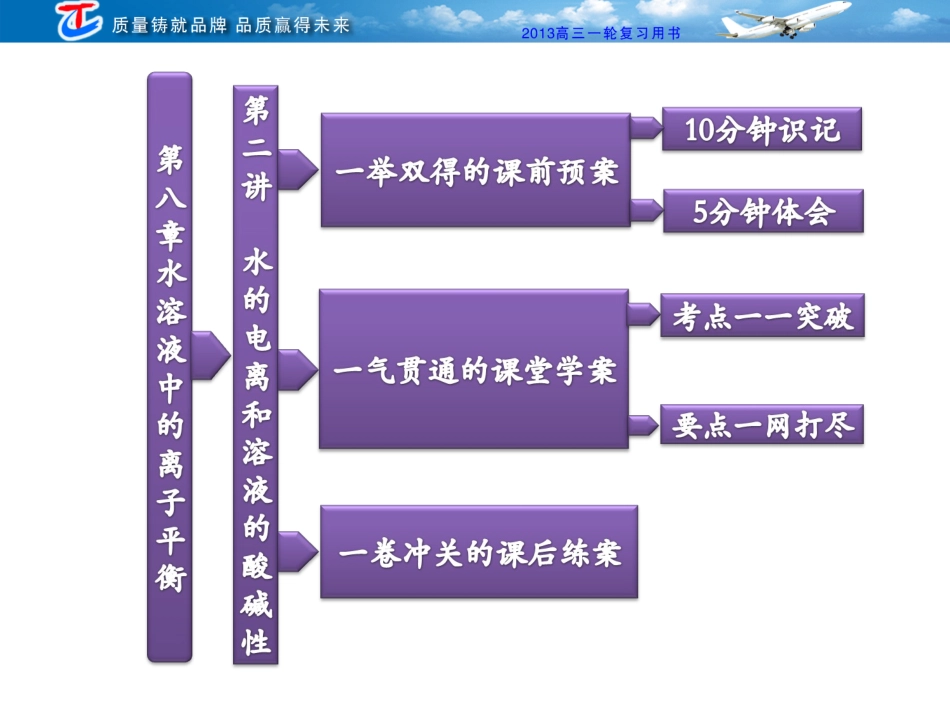
一、水的电离1.电离方程式水是一种极弱的电解质,其电离方程式为:。H2OH++OH-2.室温下纯水的有关数据(1)c(H+)=c(OH-)=。(2)KW=c(H+)·c(OH-)=。(3)pH=。3.KW的影响因素KW只与温度有关,温度升高,KW。1.0×10-71.0×10-147增大[思考·感悟]1.25℃时,纯水的离子积KW=1.0×10-14,那么,25℃时,在盐酸、NaOH溶液中的KW是多少?[提示]只要温度不变(25)℃,不论在酸、碱、盐溶液中,KW均为1.0×10-14。二、溶液的酸碱性与pH1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。c(H+)、c(OH-)的关系室温/25℃数值pH中性溶液c(H+)c(OH-)c(H+)=c(OH-)=7=1.0×10-7=c(H+)、c(OH-)的关系室温/25℃数值pH酸性溶液c(H+)c(OH-)c(H+)1×10-7mol·L-17碱性溶液c(H+)c(OH-)c(H+)1×10-7mol·L-17><><<>2.pH(1)定义式:pH=。(2)意义:表示溶液酸碱性的强弱,pH越小,酸性。越强-lgc(H+)(3)pH试纸的使用:①方法:把小片试纸放在表面皿上,用玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸变色后,与标准比色卡对比即可确定溶液的pH。②注意:a.pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能产生误差;b.用pH试纸读出的pH值只能是整数。[思考·感悟]2.某溶液的pH=7,该溶液是否一定呈中性?[提示]溶液酸碱性的判断与溶液的pH是否等于7没有直接的关系,而应比较溶液中c(H+)与c(OH-)的大小。用pH是否等于7判断溶液酸碱性只适用于室温下的溶液,而用c(H+)与c(OH-)的大小判断酸碱性,不受条件限制,适用于任何温度下的溶液。三、酸碱中和滴定1.实验用品(1)仪器:滴定管(如图A)、滴定管(如图B)、滴定管夹、铁架台、锥形瓶。酸式碱式(2)试剂:标准液、待测液、指示剂、蒸馏水。2.实验操作(以标准盐酸滴定待测NaOH溶液为例)(1)滴定前的准备:①滴定管:检查是否漏水→洗涤→→装液→调液面→记录。②锥形瓶:注碱液→记读数→加指示剂。润洗(2)滴定:左手控制活塞,右手振荡锥形瓶,眼睛注视变化,滴定至终点时,记录标准液的体积。(3)终点判断:等到滴入最后一滴标准液,指示剂变色,且,视为达到滴定终点。锥形瓶内溶液颜色半分钟内不褪色3.数据处理:按上述操作重复2~3次,求出用去标准盐酸体积的平均值,根据c(NaOH)=c酸·V酸VNaOH进行计算。[思考·感悟]3.实验室要准确取用20.00mLKMnO4溶液,应使用哪种滴定管?[提示]使用酸式滴定管,原因是KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管。1.(2011·海南高考)用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为()A.22.30mLB.22.35mLC.23.65mLD.23.70mL解析:滴定管的“0”刻度在上,22.00和23.00之间有10个格,每个格代表0.10,滴定管中的液面的正确读数为22.35mL。答案:B2.下列溶液一定呈中性的是()A.c(H+)=c(OH-)=10-6mol·L-1的溶液B.pH=7的溶液C.使石蕊试液呈紫色的溶液D.酸与碱恰好完全反应生成正盐的溶液解析:溶液呈中性,则c(H+)=c(OH-),A项正确;如果升高温度,水的KW增大,pH=7的溶液则会显碱性,故B项不正确;常温下在pH=5~8的溶液中石蕊均显紫色,所以C项中溶液可显酸性或碱性;D项中生成的正盐如果能够水解,溶液有可能不呈中性。答案:A3.填写下表:结果条件水的电离平衡的移动方向填“向左”或“向右”c(H+)变化pH的变化KW的变化溶液的酸碱性加少量浓盐酸加少量固体NaOH加入NH4Cl(s)加热解析:水溶液中存在水的电离平衡:H2OH++OH-加入盐酸、NaOH均使水的电离平衡逆移。加入NH4Cl,由于NH+4水解能促进水的电离;水的电离是吸热过程,加热能使水的电离平衡正移;只要温度不变,KW不变,升高温度,KW增大。答案:向左增大变小不变酸性增强向左减小增大不变碱性增强向右增大减小不变酸性增强向右增大变小变大不变4.将下列常温下溶液的pH用短线连接起来:溶液组成溶液pH(1)0.01mol/L的盐酸(2)0.01mol/L的NaOH溶液(3)1mLpH=3的盐酸加水稀释至10mL(4)pH=1的盐酸与pH=13的NaOH溶液等体积混合(5)50mL0.2mol/LBa(OH)2溶液与50mL0....