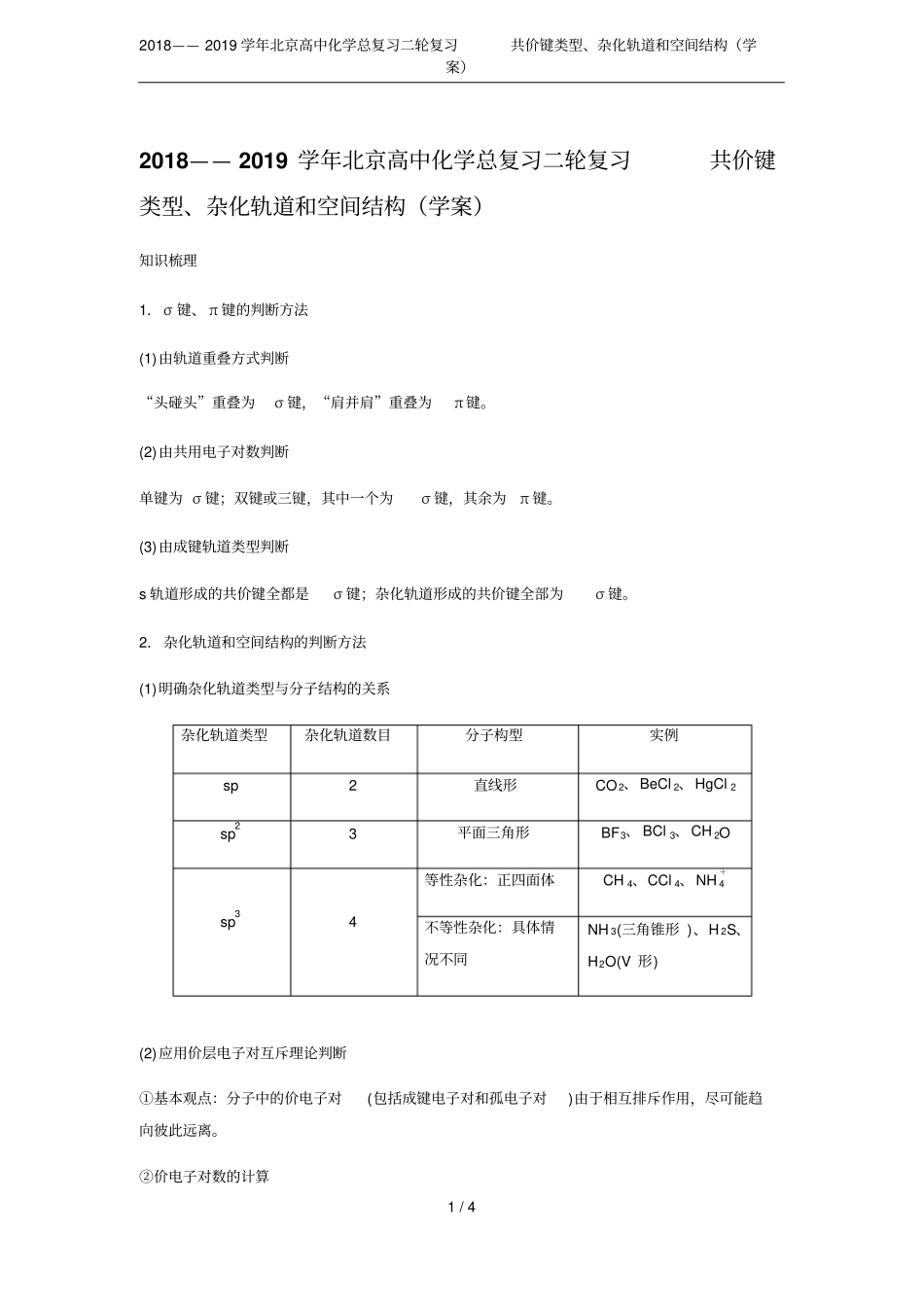
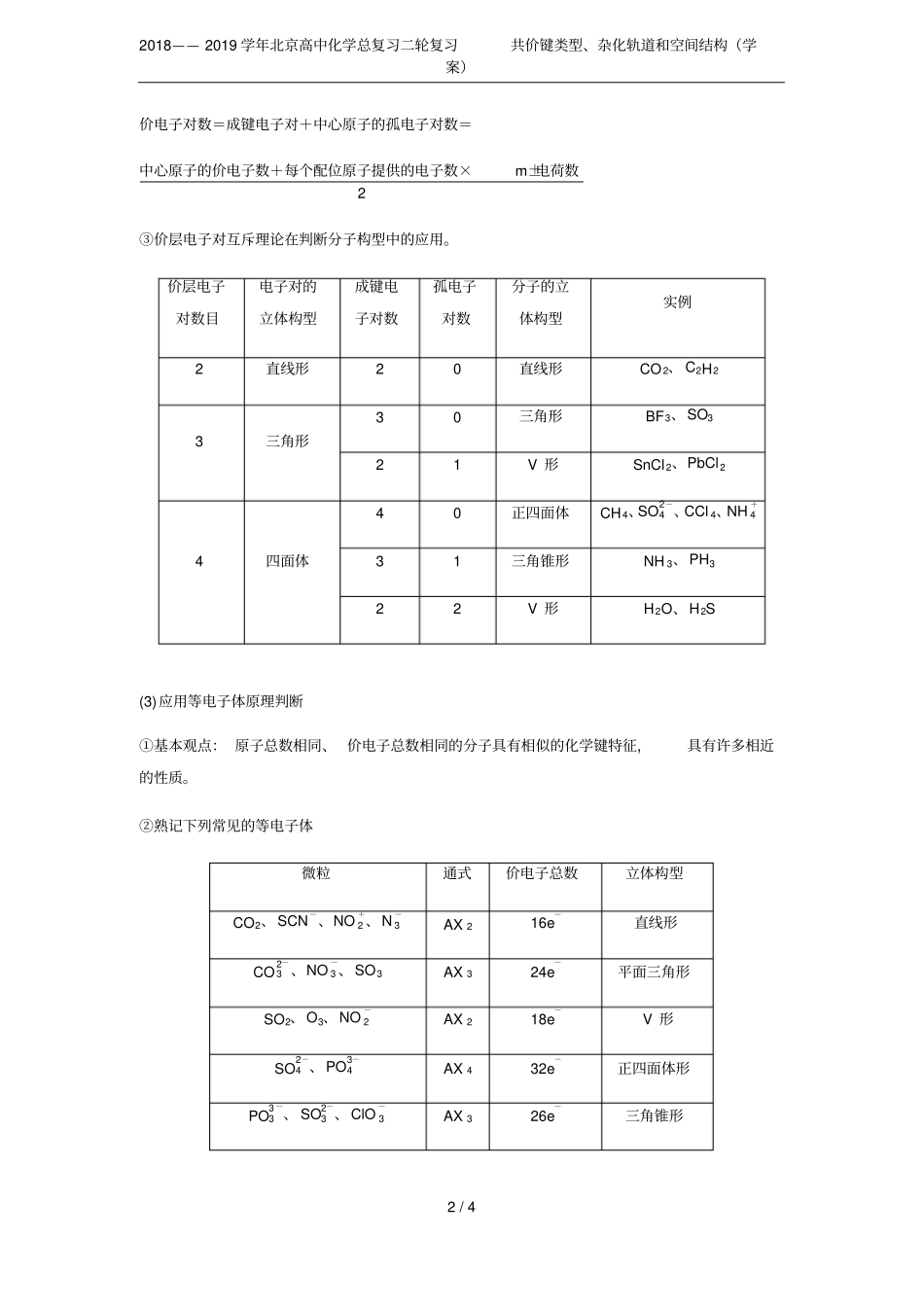
2018——2019学年北京高中化学总复习二轮复习共价键类型、杂化轨道和空间结构(学案)1/42018——2019学年北京高中化学总复习二轮复习共价键类型、杂化轨道和空间结构(学案)知识梳理1.σ键、π键的判断方法(1)由轨道重叠方式判断“头碰头”重叠为σ键,“肩并肩”重叠为π键。(2)由共用电子对数判断单键为σ键;双键或三键,其中一个为σ键,其余为π键。(3)由成键轨道类型判断s轨道形成的共价键全都是σ键;杂化轨道形成的共价键全部为σ键。2.杂化轨道和空间结构的判断方法(1)明确杂化轨道类型与分子结构的关系杂化轨道类型杂化轨道数目分子构型实例sp2直线形CO2、BeCl2、HgCl2sp23平面三角形BF3、BCl3、CH2Osp34等性杂化:正四面体CH4、CCl4、NH+4不等性杂化:具体情况不同NH3(三角锥形)、H2S、H2O(V形)(2)应用价层电子对互斥理论判断①基本观点:分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,尽可能趋向彼此远离。②价电子对数的计算2018——2019学年北京高中化学总复习二轮复习共价键类型、杂化轨道和空间结构(学案)2/4价电子对数=成键电子对+中心原子的孤电子对数=中心原子的价电子数+每个配位原子提供的电子数×m±电荷数2③价层电子对互斥理论在判断分子构型中的应用。价层电子对数目电子对的立体构型成键电子对数孤电子对数分子的立体构型实例2直线形20直线形CO2、C2H23三角形30三角形BF3、SO321V形SnCl2、PbCl24四面体40正四面体CH4、SO2-4、CCl4、NH+431三角锥形NH3、PH322V形H2O、H2S(3)应用等电子体原理判断①基本观点:原子总数相同、价电子总数相同的分子具有相似的化学键特征,具有许多相近的性质。②熟记下列常见的等电子体微粒通式价电子总数立体构型CO2、SCN-、NO+2、N-3AX216e-直线形CO2-3、NO-3、SO3AX324e-平面三角形SO2、O3、NO-2AX218e-V形SO2-4、PO3-4AX432e-正四面体形PO3-3、SO2-3、ClO-3AX326e-三角锥形2018——2019学年北京高中化学总复习二轮复习共价键类型、杂化轨道和空间结构(学案)3/4CO、N2AX10e-直线形CH4、NH+4AX48e-正四面体形强化训练1.[2018·全国卷Ⅰ,35(3)]LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________、中心原子的杂化形式为________。LiAlH4中,存在________(填标号)。A.离子键B.σ键C.π键D.氢键答案正四面体sp3AB2.[2018·全国卷Ⅲ,35(4)]《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________,C原子的杂化形式为________________________________________________________________________。答案平面三角形强化p23.[2017·全国卷Ⅰ,35(3)]X射线衍射测定等发现,I3AsF6中存在I+3离子。I+3离子的几何构型为________,中心原子的杂化类型为________。答案V形sp34.[2017·江苏,21(2)]丙酮()分子中碳原子轨道的杂化类型是________,1mol丙酮分子中含有σ键的数目为________。答案sp2和sp39NA5.CS2分子中,共价键的类型有____________,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子____________。答案σ键和π键spCO2、COS6.磷和氯反应可生成组成比为1∶3的化合物,该化合物的立体构型为________________,中心原子的杂化轨道类型为________。答案三角锥形sp37.石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被2018——2019学年北京高中化学总复习二轮复习共价键类型、杂化轨道和空间结构(学案)4/4氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。(1)图甲中,1号C与相邻C形成σ键的个数为________。(2)图乙中,1号C的杂化方式是____________,该C与相邻C形成的键角________(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。答案(1)3(2)sp3<8.甲醛(H2C==O)在Ni催化作用下加氢可得甲醇(CH3OH),甲醇分子内C原子的杂化方式为________,甲醇分子内的O—C—H键角________(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。答案sp3小于9.(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是______________。(2)H2Se的酸性比H2S________(填“强”或“弱”);气态SeO3分子的立体构型为________________,SO2-3离子的立体构型为______________。答案(1)sp3(2)强平面三角形三角锥形