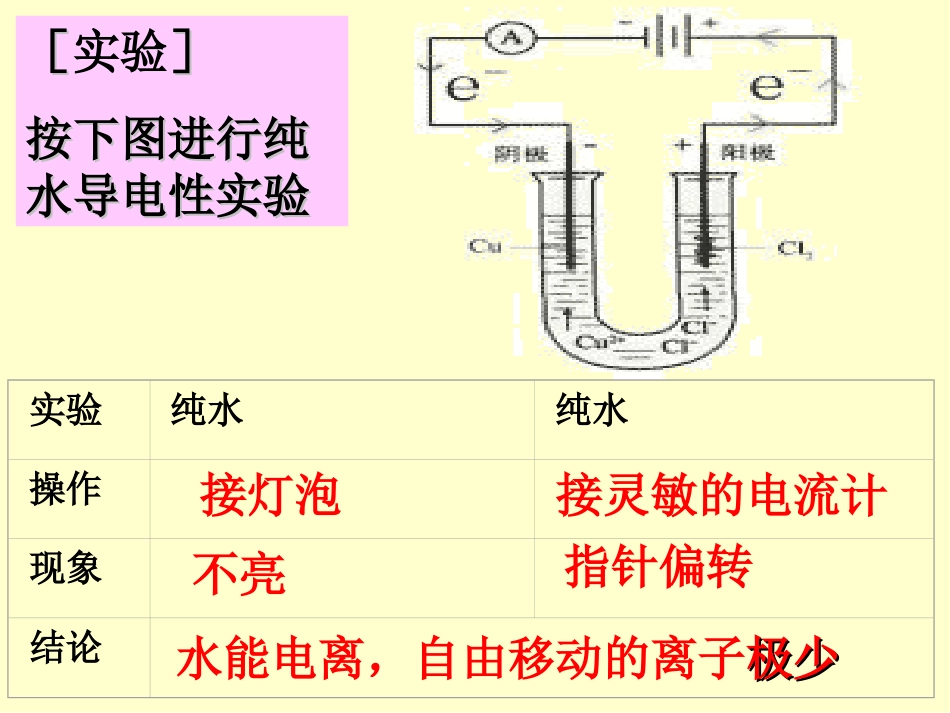
第二节水的电离与溶液的酸碱性[问题讨论][问题讨论]----------水能电离吗?怎样验证?水能电离吗?怎样验证?[[实验]]按下图进行纯按下图进行纯水导电性实验水导电性实验实验纯水纯水操作现象结论接灯泡接灵敏的电流计不亮指针偏转水能电离,自由移动的离子极少极少一、水的电离一、水的电离1.水是一种极弱的电解质-------能发生微弱的电离。电离产生等量的H+离子和OHˉ离子22水的电离方程式水的电离方程式H2O+H2OH3O++OHˉH△>0水合氢离子简写为:H2OH++OHˉH△>0水达到电离平衡时有:K(µçÀë)C(H2O)C(OH-)C(H+)=C(H+)·C(OH-)=K(电离)·C(H2O)将C(H2O)看作一个常数所以:C(H+)·C(OH-)=Kw(常数)水的离子积常数(1)定义---------一定温度下,水溶液中氢离子浓度[C(H+)]与氢氧根离子浓度[C(OH-)]的乘积为一常数,把这一常数叫做水的离子积常数,简称为水的离子积。用符号Kw表示3水的离子积常数Kw即:Kw=C(H+)·C(OH-)=常数Kw的变形式有:Kw=C(H+)C(OH-)Kw=C(H+)C(OH-)[注意]a25(℃常温)下的纯水纯水:C(H+)=C(OH-)=1×10-7mol/LKw=C(H+)·C(OH-)=1×10-7mol/L×1×10-7mol/L=1×10-14(mol/L)2即:25℃时Kw=1×10-14(mol/L)2b100(℃常温)下的纯水纯水:[讨论]-------25℃时,酸、碱、盐的水溶液的Kw仍然为1×10-14(mol/L)2?为什么?是C(H+)=C(OH-)=1×10-6mol/LKw=C(H+)·C(OH-)=1×10-6mol/L×1×10-6mol/L=1×10-12(mol/L)2d在不同溶液中,C(H+)和C(OH-)不一不一定相等定相等,但任何溶液中由但任何溶液中由水电离水电离出的出的CC(H(H++))和和C(OHC(OH--))总是相等的总是相等的c水的离子积常数,不仅适用于纯水不仅适用于纯水,也适用于任何稀的酸性、碱性和中性酸性、碱性和中性的水溶液表3-2不同温度下水的离子积常数温度0℃20℃25℃50℃100℃Kw0.134×10-140.681×10-141.01×10-145.47×10-145.50×10-14表中的数据有何规律?a温度升高温度,Kw增大,降低温度,Kw减少(2)影响Kw的因素------温度(T)即:T(温度)Kw水的电离程度b浓度--------Kw不受不受C(H+)或C(OH-)的影响[讨论]------影响水的电离平衡移动的因素酸碱性水的电离平衡移动方向C(H+)C(OH-)C(H+)与C(OH-)大小关系Kw变化加热加HCl加NaOH小结对常温下的纯水进行下列操作,完成下表:H2OH++OHˉH△>0中性酸性碱性加入酸或碱都抑制水的电离向右增大增大C(H+)=(OH-)增大向左向左增大减小减小增大不变不变C(H+)>(OH-)C(H+)<(OH-)题型1:-------求溶液中的C(H+)aq或C(OH-)aq(3)利用Kw的定量计算题型2:(难题)------求溶液中由水电离出由水电离出的C(H+)水或C(OH-)水例1:25℃时,0.01mol/LNaOH溶液中:(1)C(H+)aq、C(OH-)aq分别为多少?(2)由水电离出的C(H+)水、C(OH-)水分别是多少?解:C(OH-)aq=C(OH-)碱+C(OH-)水=C(OH-)碱=0.01mol/LNaOH==Na++OH-H2OH++OHˉC(H+)aq=C(H+)水∴C(H+)水==C(OH-)水Kw=C(OH-)aq·C(H+)aq=C(OH-)碱·C(H+)水C(H+)Ë®=C(OH-)¼îKwC(H+)Ë®=110-140.01mol/LC(H+)水=1.0×10-12mol/L所以:C(H+)aq=C(H+)水=C(OH-)水=1.0×10-12mol/L例2:25℃时,0.01mol/L盐酸溶液中:(1)C(H+)aq、C(OH-)aq分别为多少?(2)由水电离出的C(H+)水、C(OH-)水分别是多少?解:C(H+)aq=C(H+)酸+C(H+)水=C(H+)酸=0.01mol/LHCl==H++Cl-H2OH++OHˉC(OH-)aq=C(OH-)水∴C(H+)水==C(OH-)水Kw=C(OH-)aq·C(H+)aq=C(OH-)水·C(H+)酸C(H+)Ëá=C(OH-)Ë®Kw=C(OH-)Ë®110-140.01mol/LC(OH-)水=1.0×10-12mol/L所以:C(OH-)aq=C(OH-)水=C(H+)水=1.0×10-12mol/L例3浓度均为0.1mol/L的下列溶液中由水电离出的C(H+)水大小关系为:①盐酸②醋酸溶液③硫酸溶液④氢氧化钠溶液②>=>①④③例4某溶液中由水电离产生的C(H+)水=1×10-12mol/L,则该溶液呈性,则该溶液中C(H+)aq为mol/L酸性或碱性1×10-12mol/L(碱性碱性)或1×10-2mol/L(酸酸性性)1.溶液的酸碱性二、溶液的酸碱性与pH值-------溶液的酸碱性酸碱性取决于溶液中的C(HC(H++))、、C(OHC(OH--))的相对大小的相对大小C(H+)、C(OH-)的相对大小25℃时的C(H+)、C(OH-)中性溶液酸性溶液碱性溶液C(H...